Noch Platz am Holster?
„Myasthenia gravis!?“ als Antwort auf eine Prüfungsfrage wie: „Nennen Sie relevante Kontraindikationen für Medikament xy“ zu geben, ist häufig von Erfolg gekrönt. Zumindest bezogen auf Medikamente, welche die neuromuskuläre Übertragung beeinflussen (u.a. Benzodiazepine und Muskelrelaxanzien). Trotz der Interaktion mit wichtigen Notfallmedikamenten wird die Myasthenie z.B. im Lehrplan für Notfallsanitäter*innen kaum beleuchtet. Dieser Beitrag soll euch etwas Licht ins Dunkel der Therapie und Notfallmedikation von Myastheniepatient*innen bringen und für den Ernstfall des Gegenübertretens einen extra „Revolver“ im Holster bieten. Außerdem besprechen wir die Erkennung und Behandlung der myasthenen Krise. Doch beginnen wir von Vorne. Denn um die Angst vor einem Bösewicht zu verlieren, muss man ihn zuerst einmal genauer kennenlernen. Also, worum handelt es sich bei dieser mysteriösen Erkrankung eigentlich?
Kurzer Steckbrief zur Myasthenie
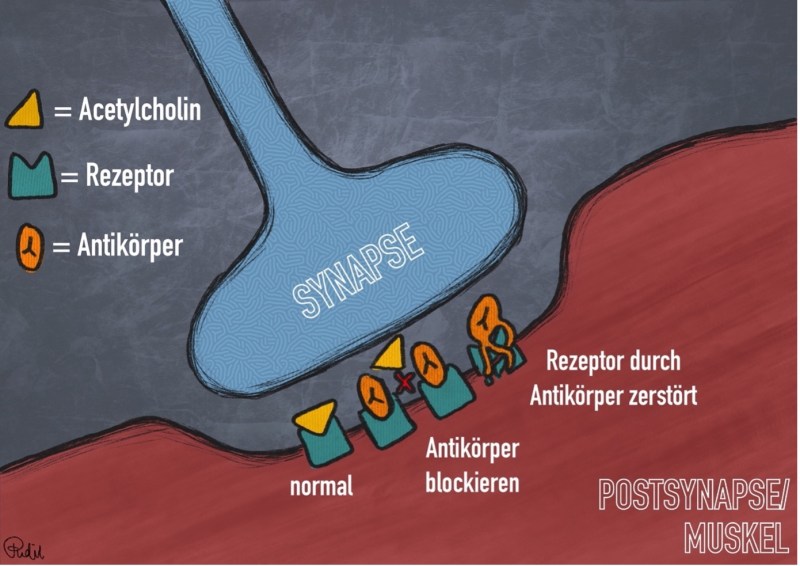
Was? Auto-Immunerkrankung, die mit einer Ermüdbarkeit der Skelettmuskulatur einhergeht
Wo? Motorische Endplatte (Hemmung der neuro-muskulären Übertragung)
Wie? Blockade und Abbau postsynaptischer nicotinischer Acetylcholinrezeptoren
Wer? Prävalenz (15/100.000 Einwohner*innen), ♀ > ♂ (3:2), jedes Alter [vgl. Carr et al.]
Warum? Virusinfektionen; Thymusveränderungen/Thymome; selten genetische Defekte
Die Erkrankung ist selten, betrifft jedoch alle Altersklassen. Hierbei ist das weibliche Geschlecht etwas häufiger betroffen und erkrankt dabei in früherem Lebensalter (Early onset < 45 Jahre). Männer erkranken häufig später (Late onset > 45 Jahre). In den meisten Fällen lässt sich die Erkrankung serologisch über Antikörper im Blut diagnostizieren.
Im Rahmen einer Myasthenie kommt es zu einer abgeschwächten Signalübertragung zwischen motorischer Nervenzelle (Motoneuron) und Muskelfaser. Wie im Steckbrief beschrieben, sind häufige Auslöser v.a. erworbene Thymusveränderungen (z.B. ein Thymom) oder Virusinfektionen (btw auch eine COVID-19 Erkrankung steht im Verdacht eine Myasthenie auslösen zu können.) Pathophysiologisch kommt es zu einer Sensibilisierung gegenüber postsynaptischen Acetylcholinrezeptoren. Langfristig resultiert daraus ein struktureller Umbau dieser nicotinischen Rezeptoren im Bereich des synaptischen Spaltes an der motorischen Endplatte.
Einteilung nach Klinik
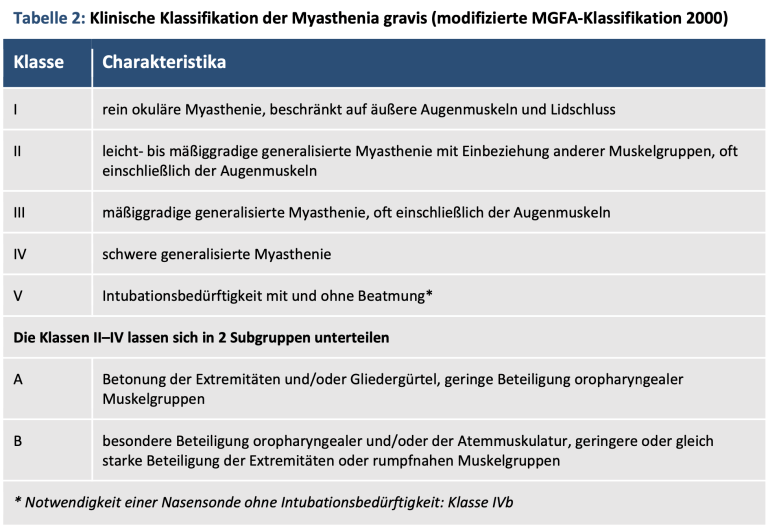
Die Myasthenia Gravis Foundation of America teilt die Myasthenie in fünf Schweregrade ein. Hervorzuheben ist an dieser Stelle besonders die Subgruppe B, die vor allem durch Beeinträchtigung der Atemmuskulatur eine akute Lebensgefahr darstellen kann.
Es existiert eine S2K Leitlinie der deutschen Gesellschaft für Neurologie (DGN) zur Diagnostik und Therapie einer Myasthenia gravis, aus welcher die oben abgebildete Tabelle stammt. Die Leitlinie wurde jedoch seit längerem nicht aktualisiert. Randnotiz: Die neonatale Myasthenie und das Lambert-Eaton-Syndrom werden an dieser Stelle nicht besprochen.
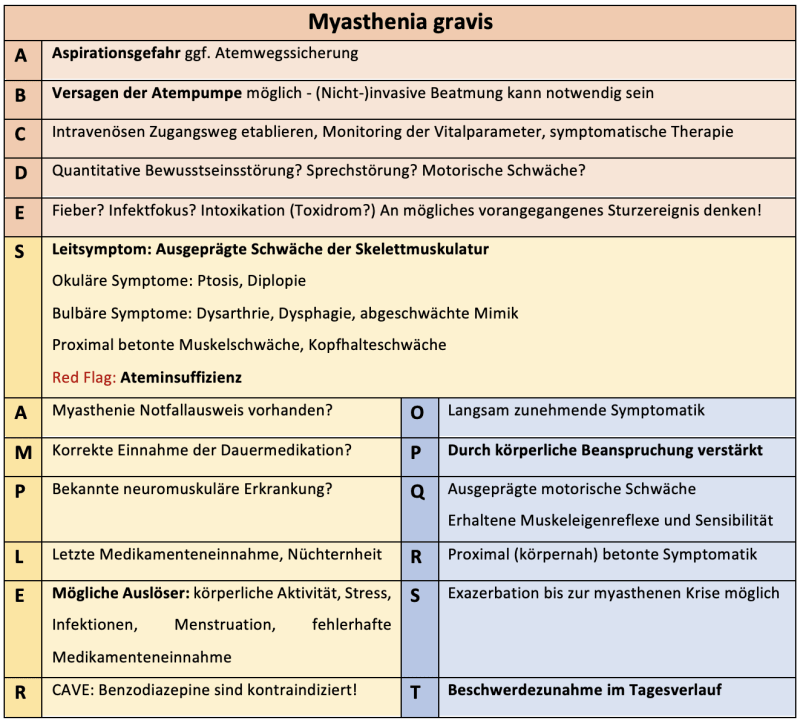
Leitsymptom der Myasthenie ist eine unphysiologische Ermüdbarkeit der Skelettmuskulatur, die sich u.a. in o.g. okulären Symptomen äußert: ein- bzw. beidseitige Ptosis (hängendes Augenlid), Diplopie (Doppelbilder sehen) und variierende Paresen der Augenmuskulatur. Des Weiteren können bulbäre Symptome (Dysarthrie, Dysphagie), abgeschwächte Mimik, Kopfhalteschwäche sowie geminderte Kraft in den Extremitäten auftreten. Eine Sturzneigung kann mit der auftretenden Muskelschwäche einhergehen. Die für die Notfallmedizin wichtigsten Empfehlungen der Leitlinie werden im Folgenden einmal kurz zusammengefasst (ohne Anspruch auf Vollständigkeit):
- Zur symptomatischen Therapie werden Acetylcholinesterasehemmer eingesetzt (Neostigmin, Pyridostigmin), um die Acetylcholinkonzentration im synaptischen Spalt zu erhöhen und damit eine Symptomlinderung zu bewirken.
- Die medikamentöse Basistherapie besteht aus einer Immunsuppression mittels Glukokortikosteroiden bzw. Azathioprin. Sie muss häufig lebenslang durchgeführt werden.
- Bei jungen Patient*innen kann innerhalb der ersten 1-2 Jahre nach Diagnosestellung eine Thymektomie (operative Entfernung der Thymusdrüse) sinnvoll sein; ggf. kann eine Strahlentherapie erwogen werden.
- Im Falle einer myasthenen Krise sollen die Autoantikörper rasch aus dem Blutplasma entfernt werden (Plasmapherese bzw. Immunglobulinbehandlung). Eine intensivmedizinische Therapie ist indiziert, ggf. wird eine invasive Beatmung nötig, je nach Ausprägung der respiratorischen Insuffizienz.
- Patient*innen sollen einen Myasthenie-Notfallausweis ständig mit sich führen:
Die myasthene Krise
Durch Infektionen, fehlerhafte Medikamenteneinnahme oder unzureichende Immunsuppression, kann es zu einer lebensbedrohlichen Exazerbation der Erkrankung kommen. Ebenfalls können gewisse (Notfall-)Medikamente eine myasthene Krise auslösen. Hierzu zählen insbesondere Benzodiazepine und Muskelrelaxanzien. Auch bestimmte Antiarrhythmika (u.a. Kalziumantagonisten), Antibiotika und (Schleifen-)Diuretika können zu einer Verschlechterung der Symptomatik führen (die S2K Leitlinie bietet in Tabelle 4 eine ausführliche Auflistung der entsprechenden Wirkstoffe).
Die gefährlichsten Pathomechanismen, die im Falle einer myasthenen Krise aus der akuten Muskelschwäche resultieren, sind eine erhöhte Aspirationsgefahr aufgrund einer Dysphagie, sowie eine respiratorische Insuffizienz durch Lähmung der muskulären Atempumpe. Die Symptome können eine Atemwegssicherung mit invasiver Beatmung notwendig machen. Laut den Daten einer Single-Center Studie aus Modena, Italien konnten retrospektiv ca. zwei Drittel der 90 beobachteten Patient*innen u.a. durch frühzeitigen Einsatz von NIV vor intensivmedizinischer und endotrachealer Intubation bewahrt werden (unter Beachtung der Kontraindikation für NIV bei hoher Aspirationsgefahr). Die Mortalität durch eine myasthene Krise beträgt in Deutschland immer noch ca. 2-3% (Quelle: Amboss). Differentialdiagnostisch sollte an einen Botulismus gedacht werden, der eine ähnliche Symptomatik aufweist (jedoch ohne Hinweis auf eine myasthene Vorerkrankung) und meist begleitet von vegetativen Begleiterscheinungen auftritt. CAVE: Gegebenenfalls können weitere Patient*innen durch einen Botulismus betroffen sein!
Das cholinerge Syndrom
Acetylcholinesterasehemmer als indirekte Parasympathomimetika steigern die Konzentration von Acetylcholin (ACh) nicht nur spezifisch im Bereich der motorischen Endplatte (sowie ganglionär im gesamten VNS), sondern beeinflussen ebenfalls die muscarinerge Übertragung an parasympathischen M-Rezeptoren. Bei (iatrogen) hohen Dosierungen der Acetylcholin-esterasehemmer (Suffix der entsprechenden Wirkstoffe: -stigmin) kann deren Wirkweise zu einem starken Überhang des Parasympathikus führen. Nerdfallmedizin und die PinUpDocs haben zu den Toxidromen bereits schöne, ausführliche Zusammenfassungen veröffentlicht.
Kurz gesagt: Patient*innen, die unter einem sogenannten M-cholinergen Syndrom leiden, sind feucht (ausgeprägte Schweiß-, Tränen und Speichelsekretion, Erbrechen sowie Harn- und Stuhlabgang), bradykard und vigilanzgemindert mit stecknadelkopfgroßen Pupillen (Miosis). Die Therapie der Wahl ist hochdosiert Atropin, titriert nach Wirkung (analog hierzu: DBRD, S.72). Ergänzend soll an dieser Stelle erwähnt werden, dass Atropin nicht mit nicotinischen Acetylcholinrezeptoren des motorischen Systems interagiert und damit u.a. eine mögliche Lähmung der Skelettmuskulatur unbeeinflusst lässt (CAVE: Atropin hat eine kürzere Halbwertszeit als einige Acetylcholinesterasehemmer).
Die Trennung zum N-cholinergen Syndrom ist vermutlich weitestgehend akademisch. Umso wichtiger ist es dennoch bei der Einschätzung von Patient*innen mit Verdacht auf ein cholinerges Syndrom zu beachten, dass es bei hohen Dosierungen der ACh-Esteraseinhibitoren theoretisch zur Beeinflussung des gesamten vegetativen Nervensystems und damit zu weiteren diffusen Symptomen wie Muskelzuckungen, bzw. -lähmungen, Blutdruckschwankungen, Tachykardie, Mydriasis etc. kommen kann.
Simpson Test
Bei diagnostischen Unsicherheiten, ob eine Myasthenie vorliegt, kann der Simpson Test versucht werden:
Der/die Patient*in wird gebeten für eine Minute aufwärtszublicken. Kommt es hierbei zu einem unwillkürlichen Herabsinken eines oder beider Augenlider (Ptosis), gilt der Test als positiv (schön zu sehen in diesem Video). Hierzu existiert auch ein Gegenversuch, bei dem geprüft wird, ob mittels lokaler Kühlung der Augenlider die auftretende Ptosis abgemildert werden kann (Eisbeutel-Test).

Notfallmedikation
Wie bereits besprochen, ist die symptomatische Therapie mit Acetylcholinesterasehemmern (z.B. Pyridostigmin, Neostigmin) eine Möglichkeit zur Überbrückung der Zeit bis zu einer weiterführenden, ursächlichen Behandlung. Glukokortikoide sollten unter besonderer Vorsicht verwendet werden, da sie hochdosiert zu einer Verschlechterung der bulbären Symptomatik (insbesondere der Dysphagie) führen können. Wird eine invasive Atemwegssicherung nötig, bietet sich die 112 Notfallnarkose als Dosierungshilfe an. Benzodiazepine sollen in diesem Fall jedoch nicht als Alternative verwendet werden, da sie die myasthene Symptomatik verstärken können. Die Gute Nachricht: Weder Opioidanalgetika noch Ketamin (yeah!!!) scheinen relevante, negative Effekte auf die Erkrankung zu haben. Diese Empfehlung zu anästhesiologischen Verfahren bei Myasthenie Patient*innen bietet einen sehr schönen Überblick! Muskelrelaxation wird bei einer Notfallnarkose kaum vermeidbar sein. Zu beachten ist hierbei die verlängerte Wirkdauer nicht-depolarisierender Muskelrelaxanzien und eine ggf. notwendige Erhöhung der Dosis bei Verwendung von Suxamethonium. Wurde nach Abwägung der Risiken eine vitale Indikation gestellt, sollte eine entsprechende Notfallmedikation nicht aufgrund einer potenziellen Verschlechterung der Myasthenie unterlassen werden! Eine ständige Absaug- und Beatmungsbereitschaft ist bei diesen Patient*innen verständlicherweise obligatorisch.
Ende gut, alles gut
Zurück zu unserem Wild-West Duell: Als gebildetes Cowgirl bzw. gebildeter Cowboy bist du bestens vertraut mit deiner mysteriösen Gegnerin, der Myasthenie. Du weißt, dass sie schnell ermüdet und Schwierigkeiten damit hat, dich zu erkennen. Außerdem ist bereits Abenddämmerung, was dir im Duell einen weiteren Vorteil verschafft, da sich ihre Symptomatik in Form der Muskelschwäche im Laufe des Tages verschlechtert. Du kannst also nicht nur zuversichtlich bleiben, sondern mit etwas Geschick sogar das Duell gewinnen, wenn du folgende Keyfacts verinnerlicht hast:
Keyfacts
- An eine Myasthenie denken, ggf. ist ein Notfallausweis vorhanden
- Acetylcholinesterasehemmer (CAVE: Cholinerge Krise induzierbar) sind Mittel der Wahl zur symptomatischen Therapie der myasthenen Krise
- Bei Auswahl der Zielklinik sollte die spezifische (intensivmedizinische) Therapiemöglichkeit von Myastheniepatient*innen berücksichtigt werden
- Die myasthene Krise bedingt eine erhöhte Aspirationsgefahr und eine Ateminsuffizienz
- Notfallmedikation sollte bedarfsgerecht und nach einer Nutzen-Risiko Abwägung erfolgen, eine Verlängerung der Wirkdauer ist möglich
- Bei vitaler Indikation soll eine adäquate (medikamentöse) Therapie nicht unterbleiben
- Benzodiazepine sollten vermieden werden… Achja und: Ketamin ist cool!

Wie immer gilt: Der Einzelfall entscheidet. Der Artikel erhebt keinen Anspruch auf Vollständigkeit oder Richtigkeit und die genannten Empfehlungen sind ohne Gewähr. Die Verantwortung liegt bei den Behandelnden. Der Text stellt die Position des Autors dar und nicht unbedingt die etablierte Meinung und/oder Meinung von dasFOAM.



