Eine Zusammenarbeit von Dr. Smiths EKG-Blog und EMCrit – übersetzt von dasFOAM in Zusammenarbeit mit Pendell Meyers
Originalautoren: Pendell Meyers, MD, Scott Weingart, MD, FCCM, Stephen Smith, MD, eine gemeinsame Bearbeitung der Übersetzung von Wilma Bergström, Aurelia Hübner, Felix Lorang, Lisa Rossbach, Joachim Unger und Justus Wolff.
Den ersten Teil des Artikels findet ihr hier.
Anhand der relevanten und in den entsprechenden Leitlinien zitierten Publikationen seit 1994 kann man das auch nachweisen:
1994: Fibrinolytic Therapy Trialists’ Group Meta-Analysis
Die FTT Meta-Analyse beweist, dass die Reperfusions-Ära eine der großen Erfolgsgeschichten der modernen Medizin ist. Es werden keine spezifischen Kriterien für die Definition von diagnostischen ST-Hebungen vorgeschlagen, da die meisten Studien keine Definition verwendet hatten und die der anderen Studien untereinander differierten.
2000: Braunwald et al, JACC: ACC/AHA Guidelines for Unstable Angina
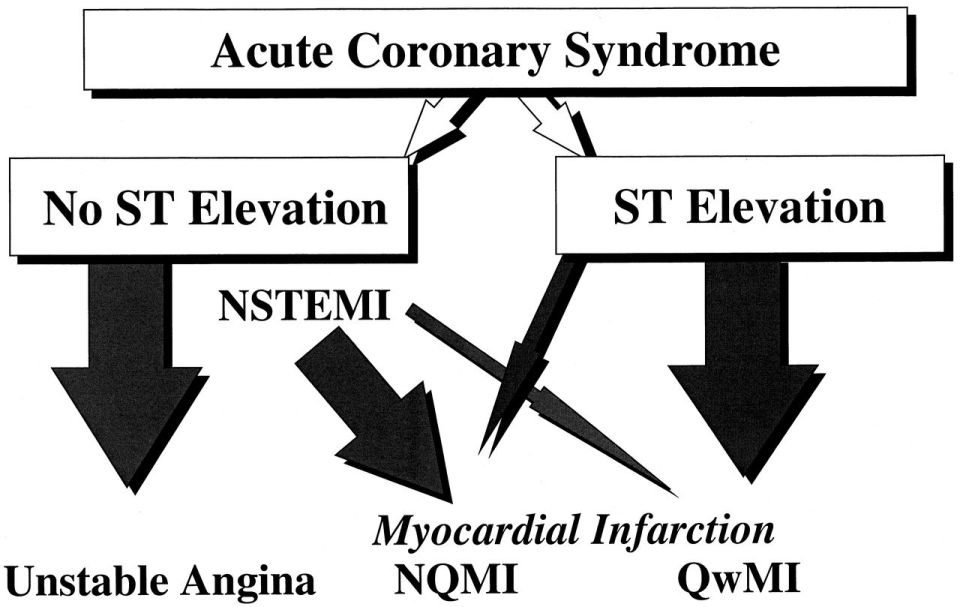
Das offizielle Paradigma des akuten Infarktmanagements verändert sich formell von “Q-Wellen vs. Nicht-Q-Wellen-MI” zu “STEMI vs. NSTEMI”.

2000: Menown et al, European Heart Journal: Optimizing the initial 12-leadelectrocardiographic diagnosis of acute myocardial infarction
Menown führte eine Fall-Kontroll-Studie mit 1190 Probanden durch. 149 gesunde Kontroll-Patienten und 1041 Patienten mit akutem Brustschmerz (335 davon hatten einen akuten Myokardinfarkt, diagnostiziert durch Biomarker einschließlich CK-MB) wurden gemischt und dann in „Trainings“ und „Validierungs“-Gruppen geteilt. In der Trainingsgruppe wurde eine logistische Regression mit verschiedenen Cutoffs der ST-Hebung durchgeführt und anschließend in der Validierungsgruppe getestet. Sie schlussfolgerten, dass der beste Cutoff bei ST-Strecken Hebungen von ≥ 2 mm in mindestens einer der anteroseptalen Ableitungen oder ≥ 1 mm in einer der anderen Ableitungen beträgt.
Mit diesen Cut-Offs klassifizierten sie 83% der Patienten korrekt als akuter oder nicht akuter Myokardinfarkt (56% Sensitivität, 94% Spezifität). Als “Myokardinfarkt” im Sinne des Endpunkts wurden hier jedoch über Biomarker (CK-MB), nicht über Angiografien definierte Infarkte gewertet, sodass auch Fälle ohne akuten Verschluss in der Infarktgruppe landeten.
Selbst wenn die Sensitivität adäquat wäre, ist die Definition des Infarkts über Biomarker nicht unser gewünschter Endpunkt. Wir versuchen viel mehr, einen akuten oder subakuten Verschluss vorherzusagen, weil dies die Patienten sind, die von einer Reperfusionstherapie profitieren. Mit Sicherheit führt ein Koronarverschluss zu erhöhten Biomarkern, aber niemand behauptet ernsthaft, dass isoliert erhöhte Biomarker eine Subgruppe des Myokardinfarkts darstellen und/oder von notfallmäßiger Reperfusion profitieren. Wie viele andere Studien aus diesem Zeitabschnitt der Literatur beinhaltet diese Studie weder Angiographie-Ergebnisse noch andere EKG-Veränderungen außer ST-Strecken Hebungen.
2000: Erste universelle Definition des Myokardinfarkts
Im Jahr 2000 veröffentlichten das American College of Cardiology und die European Society of Cardiology ihre ersten kombinierten “STEMI-Kriterien”, die sich auf die FTT-Metaanalyse und den Artikel von Menown et al. berufen. Sie sind identisch mit den oben von Menown abgeleiteten Kriterien.

2001: Macfarlane et al: Alter, Geschlecht und die ST-Amplitude bei Gesundheit und Krankheit
Macfarlane argumentierte, dass normale, gesunde Menschen unterschiedlich hohe ST-Hebungen in ihren Basis-EKGs haben, dies scheint sich je nach Alter und Geschlecht zu unterscheiden. 1338 EKGs gesunder Patienten wurden überprüft und alters-/geschlechtsspezifische normale Cutoffs wurden für jede der 12 klassischen Ableitungen festgelegt. Dabei konnte gezeigt werden, wie sehr sich die Menge an STE auf Basis-EKGs abhängig von Alter und Geschlecht ändert. Er folgerte: “Es ist klar, dass jedes diagnostische Kriterium für ST-Anomalien auf der Kenntnis dieser Änderungen beruhen muss.”
 Anmerkung: diese Werte sind in Millivolt (mV). 0,1 mV = 1 Millimeter (mm)
Anmerkung: diese Werte sind in Millivolt (mV). 0,1 mV = 1 Millimeter (mm)
Macfarlane hat einen bestimmten EKG-Befund (ST-Streckenhebungen) bei gesunden Patienten mit normaler Überleitung untersucht, die vermutlich zum Untersuchungszeitpunkt keinen akuten Verschluss haben. Daraus ergibt sich, dass eine ST-Streckenhebung in der Tat häufig ist und sogar bei bestimmten Alters-/Geschlechtsgruppen stark variiert. Leider sagt das nichts über die EKG-Befunde von Patienten aus, die tatsächlich einen akuten Verschluss haben. Andere wichtige Aspekte des gesunden, normalen EKGs beschreibt er ebenfalls nicht (R-Wellenamplitude, QT-Intervall, T-Wellengröße relativ zum QRS-Komplex, Fläche unter ST-Segment und T-Welle, Vorhandensein von pathologischen Q-Wellen, QRS-Amplitude, QRS-Fragmentierung / Verzerrung, J-Wellen, usw).
2003: Wu et al, International Journal of Cardiology. Normal limits of the electrocardiogram in Chinese subjects.
Ganz ähnlich wie Macfarlane sammelten Wu und Kollegen EKGs von 5.360 offensichtlich gesunden chinesischen Erwachsenen (3.614 Männer und 1.746 Frauen im Alter von 18 bis 84 Jahren). Die oberen und unteren Grenzen verschiedener EKG-Messungen wurden dokumentiert und die Unterschiede zwischen Alter und Geschlecht analysiert. Hier konnte bestätigt werden, dass eine ST-Streckenhebung durchaus üblich ist, wobei 2% der Männer im Alter von 18 bis 40 Jahren in den Ableitungen V1 und V2 drei oder sogar mehr Millimeter an ST-Streckenhebung am J-Punkt aufwiesen. Die Autoren kommen zu dem Schluss, dass “einige dieser Befunde im Widerspruch zu etablierten diagnostischen EKG-Kriterien stehen.
Dass diese Befunde mit den STEMI-Kriterien nicht übereinstimmen, liegt daran, dass die ST-Hebungskriterien bei der Differenzierung zwischen normalen und pathologischen ST-Hebungen nicht präzise sind. Diese Studie wird dennoch in allen folgenden Leitlinien zitiert.
2004: ACC / AHA STEMI Guidelines
ACC und AHA empfehlen stattdessen ST-Hebungen von > 1 mm in zwei zusammenhängenden Ableitungen als Indikator für eine fibrinolytische Therapie (Klasse 1A-Empfehlung).

2004: Macfarlane et al., Journal of Electrocardiology: Age, Sex, and the ST Segment in Health and Disease
Macfarlane und Kollegen nahmen an, dass alters- und geschlechtsspezifische Cutoffs den Myokardinfarkt besser vorhersagen als die Kriterien der ersten universellen STEMI-Definition. Sie verwendeten logistische Regressionstechniken, um überarbeitete STEMI-Kriterien aus einem Trainingssatz von 2285 Patienten (789 mit Brustschmerzen und 1496 normale Erwachsene) abzuleiten. Anschließend testeten sie die abgeleiteten Kriterien an 1220 unterschiedlichen Patienten mit Brustschmerzen (248 mit akutem MI definiert durch Biomarker, 972 ohne. Da diese Kohorte aus den 1980er Jahren stammte, war der verwendete “Biomarker” CK-MB, nicht Troponin). Koronarangiographische Endpunkte wurden nicht eingeschlossen. Die abgeleiteten Kriterien sind fast unmöglich zu entziffern, ganz zu schweigen vom Kleingedruckten: “Außerdem gibt es bestimmte weitere Einschränkungen”. Mit dieser zusätzlichen Komplexität konnten sie die Sensitivität gerade einmal von 42% auf 47% und die Spezifität von 96% auf 99% erhöhen.
 Erneut lässt der Mangel an koronarangiographischen Ergebnissen den Leser daran zweifeln, ob die Autoren überhaupt verstanden haben, dass STEMI den akuten Koronarverschluss und Mortalitätsvorteile durch sofortige Reperfusionstherapie vorhersagen soll. Wir versuchen nicht, EKG-Befunde mit erhöhten Biomarkern zu korrelieren sondern wir versuchen sie mit einem akuten Verschluss zu korrelieren, damit wir wissen, wen wir in den Herzkatheter bringen müssen, um den Zelltod zu verhindern, der zur Freisetzung der Biomarker führt. Selbst wenn die Autoren koronarangiographische Ergebnisse verwendet haben, zeigt es immer noch das eingeschränkte Denken, dass nur die ST-Segmente von Bedeutung sind - trotz der erstaunlich komplexen Kriterien, die vorgeschlagen werden, werden keine anderen EKG-Befunde außer der ST-Hebung mit einbezogen. Obwohl diese Kriterien in keiner anderen Literatur, die wir gefunden haben, wieder auftauchen, wird auf diese Studie in den zukünftigen Leitlinien immer wieder Bezug genommen.
Erneut lässt der Mangel an koronarangiographischen Ergebnissen den Leser daran zweifeln, ob die Autoren überhaupt verstanden haben, dass STEMI den akuten Koronarverschluss und Mortalitätsvorteile durch sofortige Reperfusionstherapie vorhersagen soll. Wir versuchen nicht, EKG-Befunde mit erhöhten Biomarkern zu korrelieren sondern wir versuchen sie mit einem akuten Verschluss zu korrelieren, damit wir wissen, wen wir in den Herzkatheter bringen müssen, um den Zelltod zu verhindern, der zur Freisetzung der Biomarker führt. Selbst wenn die Autoren koronarangiographische Ergebnisse verwendet haben, zeigt es immer noch das eingeschränkte Denken, dass nur die ST-Segmente von Bedeutung sind - trotz der erstaunlich komplexen Kriterien, die vorgeschlagen werden, werden keine anderen EKG-Befunde außer der ST-Hebung mit einbezogen. Obwohl diese Kriterien in keiner anderen Literatur, die wir gefunden haben, wieder auftauchen, wird auf diese Studie in den zukünftigen Leitlinien immer wieder Bezug genommen.
2007: 2. Universelle Definition von Myokardinfarkt
Internationale Leitlinien empfehlen jetzt zwei zusammenhängende Ableitungen mit mindestens 1,0 mm ST-Streckenhebung. Ausgenommen sind die Ableitungen V2 und V3, die 1,5 mm bei Frauen und 2,0 mm bei Männern erfordern.
2009: AHA / ACCF / HRS Standardisierung und Interpretation des Elektrokardiogramms
Die Hauptautoren Galen Wagner und Peter Macfarlane stellen erstmals die aktuellen “STEMI-Kriterien” vor und zitieren Macfarlane et al. sowie Wu et al. Sie empfehlen, dass zwei zusammenhängende Ableitungen die hier aufgeführten STE-Kriterien erfüllen sollen:
 2012: 3. Universelle Definition des MI
2012: 3. Universelle Definition des MI
Die Kriterien sind identisch mit den obigen AHA / ACCF / HRS-Kriterien von 2009 und sind derzeit die weltweit empfohlenen Kriterien. Allerdings scheinen sie nicht zu verstehen, dass andere mögliche EKG-Befunde, wie hyperakute T-Wellen, gleichfalls einen akuten Koronarverschluss darstellen können (und die Patienten von einer sofortigen Intervention profitieren könnten). Wie diese Veränderungen diagnostiziert oder behandelt werden sollten, dazu gibt es bisher keine Empfehlung in den Leitlinien.
2018: Das bringt uns in die Gegenwart. Wie Sie sehen können, hat die Mainstream-Literatur und die Entwicklung der Leitlinien von 1994 bis 2018 trotz Millionen von akuten Koronarverschlüssen und Koronar-Interventionen in dieser Zeit fast völlig kritisches Denken und methodische Strenge ausgeklammert. Keine der Leitlinien scheint zu berücksichtigen, dass ein akuter Herzinfarkt, der durch Biomarker diagnostiziert wird, nicht das Ergebnis ist, an dem wir uns orientieren sollten. Es hat den Anschein, als ob kein Autor der Leitlinien darüber nachgedacht hat, ob der akute Koronarverschluss im EKG möglicherweise auch woanders als nur in den ST-Segmenten diagnostiziert werden kann. Parallel dazu haben Akutmediziner wie Dr. Smith und viele andere Lehrbücher, Studien und FOAM-Ressourcen erstellt, die zeigen, wie wir unsere EKG-Interpretation über diese rudimentäre Ebene hinaus verbessern können. Trotzdem werden diese Fortschritte in der entsprechenden Literatur nicht berücksichtigt.
Jetzt verstehen Sie, dass die Entwicklung der STEMI-Kriterien nach 1994 vermutlich zu simpel und unkritisch erfolgt ist und könnten vermuten, dass es dafür auch Beweise gibt, dass STEMI-Kriterien bei der Identifizierung von akuter Coronarer Okklusion ungenau sind. Die gibt es:
Teil II: Wie und warum “STEMI-Kriterien” fehlschlagen
# 1: Mit dem aktuellen “STEMI” -Paradigma wird bei 25-30% der Patienten, die wir als “NSTEMI” einstufen, eine akute Koronarokklusion übersehen.
Schmitt et al. Diagnosis of acute myocardial infarction in angiographically documented occluded infarct vessel: limitations of ST-segment elevation in standard and extended ECG leads.
1788 Patienten mit akutem MI (diagnostiziert durch klinische Symptome und positive CK-MB) wurden prospektiv eingeschlossen und alle erhielten eine sofortige Koronarangiographie. 418 von diesen 1788 (23%) hatten einen akuten Koronarverschluss. Von den 418 Patienten mit akutem Koronarverschluss erfüllten 29% nicht die “STEMI-Kriterien”. Die höchste Fehlerrate (50%) wurde bei Patienten mit akutem RCX-Verschluss festgestellt. In der folgenden Grafik sehen Sie den Anteil der Koronarverschlüsse, die anhand der STEMI-Kriterien, unterteilt nach Koronararterien und Vorhandensein von EKG-Veränderungen, identifiziert wurden.

Wang et al. Inzidenz, Verteilung und prognostische Bedeutung von okkludierten Täterarterien bei Patienten mit akutem Koronarsyndrom ohne ST-Hebung, die sich einer diagnostischen Angiographie unterziehen.
Eine Post-hoc-Analyse der randomisiert-kontrollierten PARAGON-B-Studie zeigte bei 1.957 Patienten mit NSTE-ACS (diejenigen, die prospektiv negativ für die STEMI-Kriterien waren), dass 528 (27%) davon ein komplett verschlossenes Gefäß (“culprit vessel”) hatten. Es gab keinen Unterschied in der Zeit von der Aufnahme bis zur Koronarangiographie zwischen den Gruppen (beide etwa 3 Tage), aber die Koronarverschlussgruppe hatte eine größere Infarktgröße (höhere Troponine) und eine höhere, risikoadjustierte Mortalität nach 6 Monaten.

From et al.: Acute myocardial infarction due to left circumflex artery occlusion and significance of ST-segment elevation.
1.500 konsekutive Patienten mit kompletter Okklusion oder Beinahe-Okklusion (≥ 90% Stenose mit TIMI <3) wurden post-hoc aus einer prospektiven PCI-Datenbank identifiziert. Ihre EKGs wurden dann erneut ausgewertet um festzustellen, ob sie die STEMI-Kriterien erfüllten (in dieser Studie ≥ 1 mm in 2 zusammenhängenden Ableitungen). Selbst mit der ungeheuren Voreingenommenheit bereits vor der EKG-Beurteilung zu wissen, dass diese Patienten alle Okklusionen oder Beinahe-Okklusionen aufwiesen, erfüllten nur 1.077 (72%) Patienten die STEMI-Kriterien, während 423 (28%) dies nicht taten. Dies ist besonders bemerkenswert, wenn man bedenkt, dass nur 1 mm als Cut-off für den anterioren MI verwendet wurde. Der empfohlene Wert für V2 und V3 beträgt derzeit 1,5 mm für Frauen, 2,0 mm für Männer > 40 Jahre und 2,5 mm für Männer < 40 Jahre.

Pride et al. Angiographic and clinical outcomes among patients with acute coronary syndromes presenting with isolated anterior ST-segment depressions.
Pride et al. führten eine Post-hoc-Analyse der randomisiert-kontrollierten TRITON-TIMI-38 Studie zum Vergleich von Prasugrel mit Clopidogrel bei ACS-Patienten, die sich einer Herzkatheteruntersuchung unterzogen, durch. Von 13.608 Patienten wurden 1.198 (8,8%) anhand isolierter anteriorer ST-Senkungen identifiziert (die daher nicht die aktuellen STEMI-Kriterien erfüllten). 314 (26,2%) dieser 1.198 Patienten hatten zum Zeitpunkt des Herzkatheters ein vollständig verschlossenes Gefäß (“culprit vessel” - definiert als TIMI-Fluss 0 oder 1). Da nur etwa 75% der ursprünglichen 13.608 Patienten tatsächlich einen Myokardinfarkt hatten, repräsentieren die 314 Patienten mit Verschluss tatsächlich eher ein Drittel der Gruppe, anstatt ein Viertel wie dargestellt. Der RCX war in dieser Studie die häufigste Lokalisation von Okklusionen (48%).
Abbas et al. Acute angiographic analysis of non-ST-segment elevation acute myocardial infarction.
Bei der Arbeit von Abbas et al. handelt es sich ebenfalls um eine Post-hoc-Analyse, diesmal der “Primäre Angioplastie bei akutem Myokardinfarkt”-Studie. Von 1.531 Patienten in der Studie gab es nur 61 Patienten ohne ST-Streckenhebung oder Linksschenkelblock, die eine sofortige Angiographie erhielten. 29 Patienten (45,8%) dieser “NSTEMI” -Gruppe hatten gemäß der Angiographie einen “TIMI = 0”-Fluss (akute Okklusion). In der Gruppe mit ST-Streckenhebung oder Linksschenkelblock hatten nur 61,5% einen akuten Verschluss (TIMI = 0).

Khan et al. Impact of total occlusion of culprit artery in acute non-ST elevation myocardial infarction: a systematic review and meta-analysis.
In dieser Meta-Analyse sind alle verfügbaren prospektiven Beobachtungsstudien oder Post-hoc-Analysen von RCTs, in die NSTEMI-Patienten prospektiv aufgenommen und dann hinsichtlich der Prävalenz von vollständig verschlossenen Arterien beurteilt wurden, eingeschlossen. Die Autoren fanden 7 Studien (von denen nur eine oben besprochen wurde, nämlich Wang et al.) mit insgesamt 40.777 NSTEMI-Patienten, von denen insgesamt 10.415 (25,5%) Koronarokklusionen aufwiesen, die durchschnittlich 24 Stunden nach der Vorstellung in der Angiographie gefunden wurden. Diejenigen mit unerkannter, akuter totaler Okklusion hatten ein höheres kurz- und langfristiges Risiko für MACE und Versterben.

Koyama et al. Prevalence of coronary occlusion and outcome of an immediate invasive strategy in suspected acute myocardial infarction with and without ST-segment elevation.
Dies ist eine erstaunliche Studie, die die Ergebnisse eines Krankenhauses zeigt, die nach einem “radikalen Wechsel von einer nichtinvasiven zu einer 24/7 verfügbaren, invasiven Strategie dokumentiert wurden. Alle Patieten mit klinisch vermutetem ACS wurden auch ohne Vorliegen einer ST-Streckenhebung invasiv behandelt, wenn die Symptome und/oder elektrokardiographischen Anomalien nicht innerhalb von ~ 20 Minuten auf eine antiischämische Behandlung ansprachen.”
STEMI wurde in dieser Studie definiert als ST-Streckenhebungen ≥ 1 mm in mindestens zwei zusammenhängenden Extremitätenableitungen und / oder ≥ 2 mm in mindestens 2 konsekutiven Brustwand-Ableitungen. Während der ersten Übergangsphase schlossen sie 279 Patienten mit STEMI und 125 mit NSTEMI ein. Von den 125 NSTEMIs hatten 59 (47%) einen TIMI 0 -Fluss (vollständige Okklusion). In der Tat zeigt eine nähere Betrachtung von Tabelle 3, dass die TIMI-Flussgrade, die unter “NSTEMI” aufgezeichnet sind, erschreckend ähnlich zu denen der “STEMI”-Patienten waren. Was wiederum bestätigt, dass sich mittels der ST-Hebung nicht zwischen Okklusion und Nicht-Okklusion (OMI vs. NOMI) differenzieren lässt. Anstelle wie in den oben zitierten Studien erst mit einer Verzögerung von drei Tagen interventionell behandelt zu werden, unterzogen sich 93% der Patienten in dieser Studie innerhalb von 6 Stunden nach der Vorstellung einem Herzkatheter. Es ist nicht überraschend, dass es, da beide Gruppen ähnliche Verschlussraten und eine ähnliche Zeit bis zur Angiographie aufwiesen, keinen Unterschied in den Endpunkten während des Aufenthaltes oder nach 6 Monaten gab.


Marti D et al. Incidence, angiographic features, and outcomes of patient presenting with subtle ST-elevation myocardial infarction.
Prospektive Beobachtungsstudie an 504 Patienten mit akuten, “persistierenden ischämischen Symptomen, die nicht auf Nitrate ansprachen, sowie jegliche ST-Hebung die für die sofortige Koronarangiographie zugelassen wurden.” Diese Patienten wurden in Gruppen mit “subtiler ST-Hebung” definiert als 0,1 bis 1 mm und solche mit “deutlicher ST-Hebung” definiert als Hebung > 1 mm in einer beliebigen Ableitung unterteilt. Primärer Endpunkt der Studie war die präprozedurale Inzidenz von Okklusion, definiert als akuter Verschluss eines Gefäßes mit TIMI 0 oder 1-Fluss, der bei 86% der 504 Patienten vorlag. 18% der Patienten mit Okklusion hatten nicht einmal in einer einzigen Ableitung eine ST-Streckenhebung von 1 mm (noch weniger in zwei konsekutiven Ableitungen mit 1 - 2,5 mm, wie es je nach Ableitung gemäß den aktuellen STEMI-Kriterien erforderlich ist).
Smith et al. Electrocardiographic differentiation of early repolarization from subtle anterior ST-segment elevation myocardial infarction.
Retrospektive Fall-Kontroll-Studie zum Vergleich von 143 elektrokardiographisch “subtil” nachgewiesenen akuten LAD-Okklusionen im Vergleich zu 70 Kontroll-Patienten mit akutem Brustschmerz und ST-Streckenhebung in der Notaufnahme, die durch serielle Biomarker und kardiologische Auswertung untersucht wurden und bei denen ein ACS ausgeschlossen wurde. 31 (22%) der Patienten mit subtiler LAD-Okklusion (9% aller 355 identifizierten LAD-Okklusionen) zeigten eine ST-Streckenhebung von ≤ 1 mm. 19 Patienten hatten in keiner Ableitung mehr als 1 mm Hebung und 8 Patienten hatten ≤ 1 mm in nur einer einzigen Ableitung. Die positive und negative Likelihood ratio der von der Leitlinie empfohlenen STEMI-Kriterien entpuppten sich in dieser Population als ausgesprochen unzureichend. Eine niedrige R-Wellenamplitude war hier ein wesentlich besserer Prädiktor für eine LAD-Okklusion als die ST-Streckenhebung. Eine 3-variable logistische Regressionsformel mit computergestützter QTc, R-Wellenamplitude in Ableitung V4 und ST-Hebung bei 60 ms nach dem J-Punkt in Ableitung V3 zeigte weit bessere Ergebnisse als jedes ST-Hebungskriterium, um eine Normalvariante der ST-Hebung von einem akuten LAD-Verschluss zu unterscheiden.

Gegenargument: “Gab es nicht RCTs, die keinen Nutzen für frühe vs. verzögerte Intervention bei NSTEMI-Patienten zeigten? Wenn ja, warum haben die Patienten mit akuten Coronarverschlüssen in diesen NSTEMI-Kohorten keinen Nutzen für die Frühinterventionsgruppen erbracht?”
Es gibt eine mäßig große Anzahl an Veröffentlichungen, die irrtümlicherweise dazu verwendet werden zu behaupten, dass es keinen Unterschied in den Ergebnissen zwischen sofortiger und zeitnaher Intervention bei NSTEMI gibt. Selbst wenn dies eine zutreffende Darstellung der Literatur wäre, würde dies die Theorie nicht widerlegen, dass die Untergruppe von NSTEMI-Patienten mit akutem Verschluss von einem sofortigem, invasiven Management profitiert. Wenn der Prozentsatz von Patienten mit akutem Verschluss in der Studienpopulation von NSTEMIs niedrig ist, wird selbst ein großer Mortalitätsvorteil (für diejenigen mit akutem Verschluss) in einer kleinen randomisiert-kontrollierten Stuide nicht beobachtbar sein. Wenn Sie fünf Patienten mit ACO sowie 300 ohne ACO randomisieren, können Sie keinen Unterschied in den Ergebnissen erkennen, selbst wenn alle fünf ACO-Patienten durch sofortige Intervention gerettet wurden. Wenn Sie die verbesserte EKG-Interpretation verwenden, um die wenigen Patienten mit ACO erfolgreich herauszufiltern, wird der Nutzen jedoch offensichtlich (weil nur die Patienten mit akuter Okklusion profitieren). Es hat noch nie eine prospektive interventionelle Studie mit verbesserter EKG-Interpretation gegeben, um die Auswirkungen von sofortiger vs. verzögerter Herzkatheteruntersuchung zu untersuchen. Wir hoffen, dies in Zukunft zu ändern.
Nichtsdestotrotz müssen wir uns zur Literatur hinsichtlich der sofortigen oder dringenden invasiven Behandlung von NSTEMI äußern, da sie häufig als Einwand gegen die Idee, dass eine Untergruppe von NSTEMI-Patienten eine sofortige Intervention benötigen könnte, verwendet wird. Die Missverständnisse in den folgenden Studien rühren im Allgemeinen daher, dass “frühe” Interventionen nicht wirklich “sofort” durchgeführt wurden und dass NSTEMI Patienten mit Ischämie, die auf eine maximale medikamentöse Therapie nicht ansprachen, aus den Studien ausgeschlossen wurden (da sie damit bereits eine Indikation für eine zeitnahe (< 2 Stunden) Angiographie gemäß den Richtlinien der ESC und den ACC / AHA-Richtlinien haben).
Mehta et al. Early versus delayed invasive intervention in acute coronary syndromes. The TIMACS (Timing of Intervention in ACS) Trial.
3031 NSTEMI Patienten wurden in „frühe” (</= 24 Stunden) vs. verzögerte (>/= 36 Stunden) Intervention randomisiert. Die mediane Zeit von Vorstellung des Patienten bis zur Koronarangiographie betrug 14 Stunden in der “frühen” vs. 50 Stunden in der verzögerten Gruppe. Da die “frühe” Intervention eben nicht tatsächlich früh erfolgte, kann die Studie nicht als Grundlage für die Entscheidung zu einer notfallmäßigen (üblicherweise innerhalb von 2 Stunden) Intervention bei NSTEMI-Patienten herangezogen werden, geschweige denn bei ACO-Patienten ohne offensichtliche ST-Hebungen. Es überrascht nicht, dass es in beiden Gruppen keinen Unterschied bezüglich Auftreten von Tod, Myokardinfarkt oder Schlaganfall gab. Auch wenn nicht in den Methoden angegeben, ergab der persönliche Austausch zwischen dem Hauptautor und Dr. Smith, dass Patienten mit refraktärer Ischämie (zu Recht) von der Studie insgesamt ausgeschlossen wurden. In den Fällen, wo die Wirkungen der Frühintervention durch den GRACE-Score stratifiziert wurden, wurde in der Gruppe mit einem GRACE-Score von > 140 eine signifikante Reduktion des primären Outcomes (zusammengesetzt aus Tod, Myokardinfarkt oder Schlaganfall) festgestellt (13,9% vs. 21,0%, P = 0,006).
Hoedemaker et al. Early Invasive Versus Selective Strategy for Non-ST-Segment Elevation Acute Coronary Syndrome: The ICTUS Trial.
Die ICTUS-Studie randomisierte 1200 NSTEMI-Patienten mit erhöhtem Troponin T zu “früh-invasivem” (innerhalb von 24 bis 48 Stunden nach Randomisierung) vs. “selektiv-invasivem” Vorgehen. Es gab keinen Unterschied in der 1-Jahres-Mortalität (2,5% in beiden Gruppen) oder spontanem Myokardinfarkt, aber einen 5%-igen absoluten Anstieg (15 vs. 10%) von Myokardinfarkten in der früh-invasiven Gruppe, welcher dem Verfahren zugeschrieben wurde. Zum 10-Jahres Follow-up gab es keinen statistischen Unterschied mehr zwischen Tod oder spontanem Myokardinfarkt (34 vs 29%). Bemerkenswerterweise wurden Patienten bei “Indikation zur Reperfusionstherapie, hämodynamischer Instabilität oder offensichtlicher kongestiver Herzinsuffizienz” ausgeschlossen, was nach den aktuellen Leitlinien die refraktäre Ischämie einschließt. Die Prävalenz der angiographischen Okklusion und detaillierte EKG-Analysen werden nicht genannt. Obwohl diese Studie keine Auswirkungen auf die notfallmäßige Reperfusionstherapie hat, verstärkt der 5%-ige absolute Anstieg des periprozeduralen Myokardinfarktes (NNH = 20) die Signifikanz der Schäden des unverzüglichen Notfallkatheters für diejenigen ohne Nutzen (jene ohne ACO)
Van’t Hof et al. A comparison of two invasive strategies in patients with non-ST elevation acute coronary syndromes: results of the Early or Late Intervention in unStable Angina (ELISA) pilot study.
220 Patienten mit NSTE-ACS wurden “früh” vs. “spät” randomisiert (mediane Zeit bis zur Angiographie 6 vs. 50 Stunden). Es gab keinen Unterschied im klinischen Outcome nach 30 Tagen Follow-up. Refraktäre Ischämien wurden ausgeschlossen. Obwohl 6 Stunden sicherlich früher als 24-48 sind, ist es immer noch nicht früh genug, um als notfallmäßige Reperfusionstherapie zu gelten. Es wurden keine detaillierte EKG-Analyse durchgeführt oder Daten über das angiographische Ausmaß der Okklusion berichtet.
Merke: refraktäre Brustschmerzen wurden ausgeschlossen. Patienten mit OMI und persistierender Okklusion haben aber in der Regel refraktäre Schmerzen, so dass genau diese Patienten ausgeschlossen wurden.
Neumann et al. Evaluation of prolonged antithrombotic pretreatment (“cooling-off” strategy) before intervention in patients with unstable coronary syndromes: a randomized controlled trial. The ISAR-COOL Study.
410 Patienten mit NSTE-ACS, aber entweder einer ST-Senkung oder einem erhöhtem Troponin-T-Spiegel, wurden in antithrombotische Vorbehandlung über 3-5 Tage oder frühe Intervention mit < 6 Stunden Vorbehandlung randomisiert. Die beiden Gruppen erhielten eine Koronarangiographie mit einem Median von 2,4 vs. 86 Stunden nach initialer Vorstellung. Alle Patienten erhielten Aspirin, Clopidogrel, Heparin und Tirofiban. In der Gruppe der „verzögerten“ Behandlung gab es eine signifikant höhere Todesrate oder “große” Myokardinfarkte als in der früh-invasiven Gruppe (11,6% vs. 5,9%, P = 0,04). Dieser Unterschied wurde durch das Auftreten von 3 Todesfällen und 10 großen Myokardinfarkten in der „verzögerten“ Behandlungsgruppe verursacht, die alle vor der Angiographie auftraten. Unglaublicherweise lautet die Schlussfolgerung der Autoren wie folgt: “Bei Patienten mit instabilen Koronarsyndrom verbessert eine Verzögerung der Intervention zur verlängerten antithrombotischen Vorbehandlung nicht das Outcome, verglichen mit einer sofortigen Intervention, die von einer intensiven Thrombozytenaggregationshemmung begleitet wird.” In Anlehnung an ihre Eröffnungsmetapher scheint die angebliche “Abkühlungs”-Phase eher die Phase eines Schwelbrandes zu sein, während der das Myokard der Patienten auf einem Brenner bruzzelt. Es wurden keine Angaben zum Ausmaß des angiographischen Verschlusses oder detaillierte EKG-Analysen gemacht.
Thiele et al. Optimal timing of invasive angiography in stable non-ST-elevation myocardial infarction: the Leipzig Immediate versus early and late PercutaneouS coronary Intervention triAl in NTSEMI (LIPSIA-NSTEMI Trial).
201 Patienten mit NSTEMI wurden in sofortige Katheterisierung (< 2 Stunden, Median 1,1 Stunden) versus 200 Patienten, die einer Katheterisierung nach 10-48 Stunden (median 18,6 Stunden) erhielten, randomisiert. Es gab in beiden Gruppen keinen Unterschied bezüglich Tod oder Myokardinfarkt innerhalb von 6 Monaten. Ausschlusskriterium war die refraktäre Ischämie. Detaillierte EKG-Analysen oder angiographische Daten bzgl. der Okklusion sind nicht verfügbar. Mit einer sehr kurzen Zeit bis zur Katheterisierung in der Gruppe der sofortigen Katheterisierung ist die wahrscheinlichste Erklärung für den fehlenden Nutzen, dass die Patienten mit nur diskreter Okklusion (welche eher refraktäre ischämische Symptome hatten) initial korrekterweise ausgeschlossen wurden.
Montalescot et al. Immediate vs delayed intervention for acute coronary syndromes: a randomized clinical trial.
352 Patienten mit NSTE-ACS und einem TIMI-Score von 3 oder höher, jedoch ohne refraktäre Ischämie, wurden in sofortige Intervention versus Intervention am nächsten Arbeitstag (nach 8 bis 60 Stunden) randomisiert. Die durchschnittliche Zeit von Randomisierung bis Katheterschleusenanlage betrug 70 Minuten gegenüber 21 Stunden zwischen den beiden Gruppen. Die medianen Spitzenwerte des Troponin-I unterschieden sich nicht in den beiden Gruppen (2,1 vs. 1,7 ng/ml). Es gab keinen Unterschied im sekundären Endpunkt, zusammengesetzt aus Tod, Myokardinfarkt oder Revaskularisation nach 1 Monat Follow-up (13,7 vs 10,2%). Daten zur Prävalenz der angiographischen Okklusion sind nicht verfügbar, ebenso wenig eine detaillierte, fachärztliche EKG-Analyse. Auch hier scheint der mangelnde Vorteil zu bestätigen, dass Patienten mit subtiler Okklusion aufgrund refraktärer Symptome richtigerweise von der Studie ausgeschlossen wurden.
Reuter et al. Early invasive strategy in high-risk acute coronary syndrome without ST-segment elevation. The Sisca randomized trial.
170 Patienten wurden primär im präklinischen Setting auf dem Boden von nicht ST-Hebungs-ACS und mindestens einem von drei EKG-Veränderungen in mindestens zwei benachbarten Ableitungen eingeschlossen:
(1) T-Welleninversion von mehr als 3 mm , (2) ST-Streckensenkung von mindestens 0,5 mm und/oder (3) eine vorübergehende ST-Strecken-Hebung von mindestens 1 mm. Diese Patienten wurden entweder in eine früh-invasive Strategie, d.h. Angiographie innerhalb von 6 Stunden, oder eine verzögert-invasive Strategie, d.h. Angiographie innerhalb von 6 Stunden nach Ermessen des Arztes, randomisiert. Da diese Patienten vor stationärer Aufnahme bereits randomisiert wurden, konnte eine “refraktäre Angina pectoris” nicht ausgeschlossen werden, da die Patienten zu diesem Zeitpunkt noch keine maximale medizinische Behandlung erhalten hatten. Die mediane Zeit von Randomisierung bis Anlage der Katheterschleuse betrug 2,8 Stunden in der früh-invasiven Gruppe im Vergleich zu 20,9 Stunden in der verzögerten Strategiegruppe.
Der primäre Endpunkt (kombinierter Endpunkt einschließlich Tod, Myokardinfarkt oder notfallmäßige Revaskularisationen nach 30 Tagen) war signifikant niedriger für die frühe invasive Gruppe (2% vs. 24%, P <0,01). Eine nähere Untersuchung zeigt jedoch, dass dieser Unterschied hauptsächlich durch 14 Patienten in der Gruppe mit verzögerter Strategie ausgelöst wurde, die vor der sechsten Stunde nach der Randomisierung eine dringende Revaskularisierung erhielten. Bei 21 Patienten der Gruppe mit verzögerter invasiver Strategie (24%) wurde die primäre Behandlungsstrategie wegen Entwicklung eines STEMI (n = 2), anhaltenden Brustschmerzen (n = 13), wiederkehrenden Schmerzen (n = 3), Arrhythmien (n = 2) und undokumentierter Ursache (n = 1) verlassen. 14 dieser Patienten erhielten eine PCI, die dann im 30-Tage-Gesamtergebnis als dringende Revaskularisation gewertet wurde. In der früh-invasiven Gruppe (1 vs.10 Myokardinfarkte, 1% vs. 12%) gab es einen Trend zur Verringerung der Indexvisiten-Myokardinfarkte, der angesichts der sehr geringen Größe der Untersuchungsgruppe keine statistische Signifikanz erreichte. Die Langzeit-Mortalität betrug 16% in beiden Gruppen nach 4,1 Jahren medianem Follow-up. Detaillierte EKG-Analysen waren nicht verfügbar und angiographische Okklusionsdaten wurden nicht angegeben.
Milosevic et al. Immediate versus delayed invasive intervention for non-STEMI patients: the RIDDLE-NSTEMI Study.
323 Patienten ohne STEMI, aber mit erhöhten Troponin I-Werten und “neuer ST-Streckensenkung um mindestens 1mV und/oder T-Welleninversion bei >/= 2 benachbarten Ableitungen” wurden randomisiert in Sofortmaßnahmen (<2h) und verzögerte Intervention (2 bis 72 Stunden). Therapierefraktäre Angina und „posteriorer Myokardinfarkt” wurden ausgeschlossen, wobei zu letzterem keine spezifischen Kriterien angegeben wurden. Die mediane Zeit von der Randomisierung bis zur Angiographie betrug 1,4 versus 61,0 Stunden. Der primäre Endpunkt (Auftreten von Tod oder neuem Myokardinfarkt nach 30 Tagen Follow-up) wurde in der Gruppe mit sofortiger Intervention weniger häufig als in der Gruppe mit verzögerter Intervention erreicht (4,3% vs. 13%, p = 0,008). Dieser Unterschied wurde fast ausschließlich durch einen Überschuss an unerwünschten Ergebnissen in der verzögerten Interventionsgruppe vor der Katheterisierung verursacht (0 Todesfälle und 0 Myokardinfarkte in der Sofortinterventionsgruppe vs. 1 Todesfall und 10 Myokardinfarkte in der verzögerten Interventionsgruppe vor Katheterisierung). Nach einem Jahr waren die Todesursachen in der Gruppe mit sofortiger Intervention insgesamt zwar nicht signifikant niedriger (4,9 vs. 5,6%), jedoch blieb die signifikante Reduktion der Myokardinfarktrate bestehen (3,1% vs. 13,8%, p = 0,002). Gleiches gilt für das kombinierte Outcome von Tod oder Myokardinfarkt (6,8% vs. 18,8%, p = 0,002). Es wurde keine detaillierte EKG-Analyse durchgeführt und die Inzidenz angiographischer Okklusionen wurde nicht angegeben.

Alle Bilder/Abbildungen stammen aus der englischen Original-Datei.


Nice blog thanks ffor posting