Bedingt durch die Eintageskonferenz Essentials of EMCrit flogen am 31.01.2018 zahlreiche Tweets zum Thema Hyperkaliämie, Ringer-Laktat, NaCl 0,9% und BRASH-Syndrom durch den Äther. Und somit ist es nach langen Versprechungen und ausführlicher Vorarbeit heute endlich auch bei uns soweit, dass das BRASH-Syndrom, bereits 2016 von Josh Farkas auf PulmCrit vorgestellt, heute auf unserer Tagesordnung steht. Wie immer als freie, transkribierte Übersetzung und natürlich mit freundlicher Genehmigung des Autors.
Einleitung
Hierbei handelt es sich um eine meiner Lieblingsdiagnosen. Wenn man zum ersten Mal damit in Kontakt kommt, erscheint die Gesamtkonstellation verwirrend und die Behandlung schwierig zu sein . Tatsächlich kann es sein, dass der ALS-Algorithmus zur Bradykardie bei diesen Patienten nicht greift. Allerdings ist diese Störung, wenn man sie einmal verstanden hat, einfach zu behandeln und im Allgemeinen erholen sich die Patienten wieder relativ rasch.
Pathophysiologie und Definition
Das BRASH-Syndrom ist als Kombination der folgenden Punkte definiert:
- Bradykardie
- Renale Insuffizienz / Versagen
- AV-Knoten Blockade: β-Blocker, Verapamil oder Diltiazem
- Schock
- Hyperkaliämie
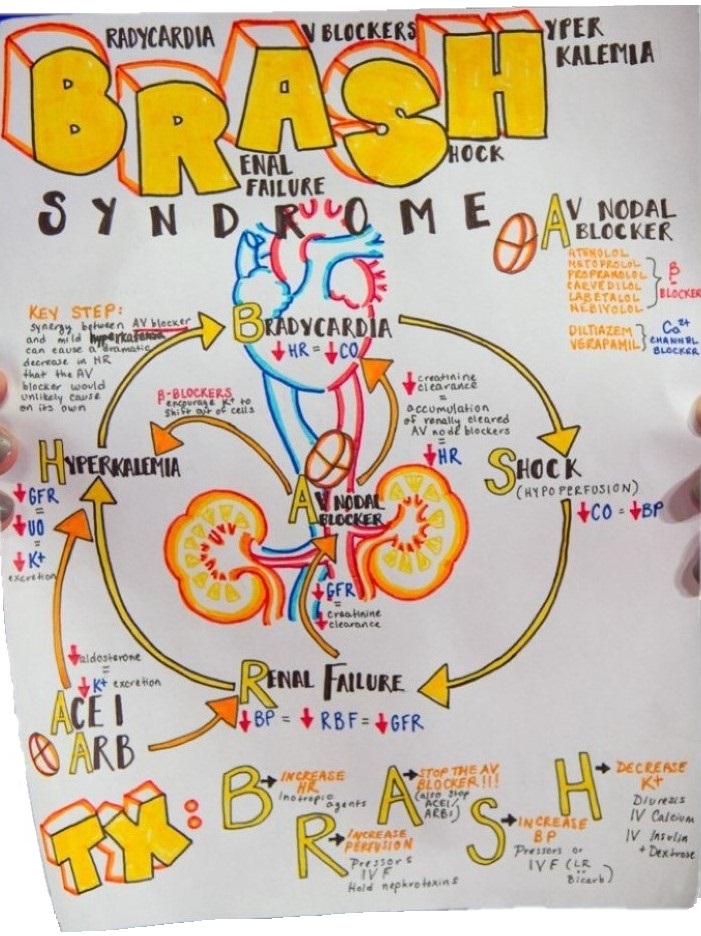
Das Syndrom entwickelt sich aufgrund eines Teufelskreis, bedingt durch die bestehende Medikation, eine Hyperkaliämie und das renale Versagen (vgl. Abbildung 1). Das Nierenversagen verursacht eine Hyperkaliämie und führt ggf. zu einer Akkumulation von AV-Knoten-Blockern (z.B. Metoprolol oder Verapamil). In Kombination mit den AV-Knoten-Blockern verursacht und verstärkt die Hyperkaliämie eine Bradykardie und Hypoperfusion, welche wiederum durch die verminderte renale Durchblutung das Nierenversagen weiter vorantreibt.
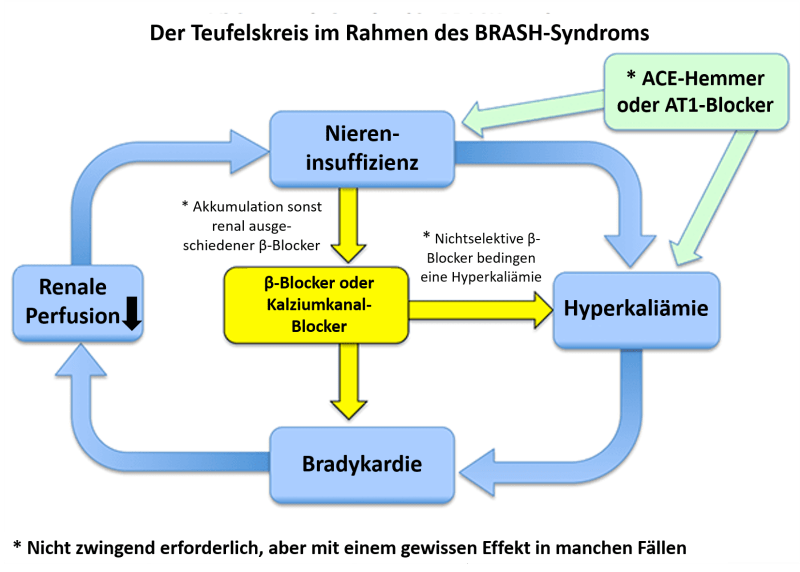
Der pathophysiologische Schlüssel zum BRASH-Syndrom ist das Problem, dass eine Hyperkaliämie synergistisch mit AV-Knoten-Blockern eine Bradykardie verursachen kann . Untersuchungen an Hunden konnten hierfür einen Beweis erbringen .
Evidenz & das BRASH-Syndrom als eigene diagnostische Entität
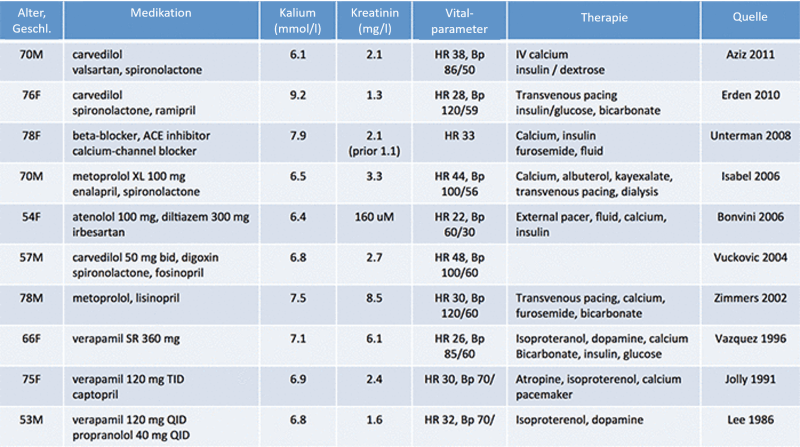
Fälle dieser Art wurden bereits von einigen Autoren beschrieben (vgl. Abbildung 2) . Nichtsdestotrotz wird dieser Symptomkomplex häufig nicht erkannt. Häufig wird lediglich die vorliegende Hyperkaliämie für das BRASH-Syndrom verantwortlich gemacht. Durch die potentielle Gefahr und ihr heterogenes Erscheinungsbild, kann das Vorliegen einer Hyperkaliämie den Behandelnden panikartig in eine Richtung laufen lassen, blind für andere Möglichkeiten, so dass die im Hintergrund lauernden AV-Knoten-Blocker völlig irrelevant erscheinen. Kommentar: Oder frei nach Amal Mattu: Der häufigste Grund eine Diagnose zu übersehen ist eine Diagnose gemacht zu haben.
Das BRASH-Syndrom bildet eine Überschneidung zwischen einer Hyperkaliämie und einer AV-Knoten-Blocker-Intoxikation. Ein paar Merkmale können helfen diese Entitäten voneinander zu unterscheiden.

BRASH-Syndrom vs. reine Hyperkaliämie:
- Schwere der Hyperkaliämie: Bei Patienten mit einem BRASH-Syndrom kann lediglich eine leichte Hyperkaliämie ausreichen. Die Bradykardie wird vielmehr durch den synergistischen Effekt zwischen Hyperkaliämie und AV-Knoten-Blocker verursacht. Im Gegensatz dazu ist für gewöhnlich ein deutlich dramatisch-erer Anstieg des Kaliums zu erwarten, wenn die Bradykardie alleinig durch die Hyperkaliämie bedingt ist.
- Unverhältnissmäßige Bradykardie im EKG: Die Abfolge der einzelnen EKG-Veränderungen im Rahmen einer Hyperkaliämie ist sehr variabel. Nichtsdestotrotz macht eine Bradykardie im EKG ohne das Vorliegen weiterer Veränderungen (wie z.B. QRS-Verbreiterung, erhöhte T-Wellen) ein BRASH-Syndrom wahrscheinlicher .
- Gleichzeitige Hyperkaliämie: Patienten mit einer β-Blocker- oder Kalziumkanalblocker-Intoxikation können eine gleichzeitige Hyperkaliämie haben, müssen aber nicht. Im Falles eines BRASH-Syndroms ist die Hyperkaliämie allerdings eine essentielle Komponente.
- Anamnese: Patienten mit einer signifikanten AV-Knoten-Blocker-Intoxikation haben in der Regel anamnestisch größere Mengen ihrer Medikation eingenommen. Im Gegensatz dazu haben sich Patienten mit einem BRASH-Syndrom in der Regel an ihre vorgeschriebene Dosierung gehalten.
Epidemiologie
Zugrunde liegende Umstände und Medikation: Das BRASH-Syndrom tritt in der Regel bei älteren Patienten auf, welche aufgrund kardialer Vorerkrankungen mit β-Blockern, Diltiazem oder Verapamil behandelt werden. Häufig besteht eine herabgesetzte Nierenfunktion mit fehlender renaler Reserve.
Auslöser: Ein BRASH-Syndrom wir häufig durch eine Hypovolämie ausgelöst (z.B. bedingt durch eine Gastroenteritis). Palmisano et al zeigten 2014, dass es in den wärmsten Sommermonaten vermehrt zu Bradykardien komme, ein Phänomen, welches sie durch Dehydratation, Hyperkaliämie und Anhäufung von β-Blockern erklärten. Andere Auslöser sind unter anderem Aufdosierung von Antihypertensiva oder kaliumsparenden Diuretika (z.B. Spironolacton), jegliche Ursache einer Hypoperfusion oder Verletzung der Nieren.
Klinisches Bild und Diagnose
Die Spannbreite der Krankheitsausprägung und -schwere ist groß, von einer asymptomatischen Bradykardie bis zum Multiorganversagen (z.B. Schock, kardiogenes Lungenödem, Nierenversagen, Leberversagen). Patienten sehen häufig besser aus, als ihre Vital- oder Laborparameter vermuten lassen. Dennoch sollte die Bradykardie und / oder Hyperkaliämie in Alarmbereitschaft versetzen.
Therapie des BRASH-Syndroms
In einigen leichteren Fällen ist es gut möglich, dass eine reduzierte medizinische Therapie (z.B. i.v.-Kalzium, Volumentherapie) ausreicht. Die folgenden angesprochenen Punkte basieren auf meiner Erfahrung in der Behandlung von ca. einem Dutzend von intensivpflichtigen Patienten, was bedeutet, dass der Fokus mehr auf den schwereren Fällen liegt.
- Hyperkaliämie: Membranstabilisierung und Kalium Verschiebung
Die unmittelbare Behandlung der Hyperkaliämie beinhaltet sowohl die intravenöse Kalziumgabe, um das Myokard zu stabilisieren, als auch i.v.-Insulin und Glukose, um Kalium in die Zellen zu verschieben. Albuterol (bei uns auch bekannt unter dem Namen Salbutamol) ist ebenfalls eine gute Idee, zum einen um Kalium nach intrazellulär zu verschieben, zum anderen, um der Bradykardie entgegen zu wirken.
- Volumentherapie im Falle einer Hypovolämie
Der Volumenstatus unterscheidet zwischen den unterschiedlichen Patienten mit BRASH-Syndrom erheblich. Einige sind massiv ausgetrocknet, wohingegen andere bedingt durch ein anurisches Nierenversagen mit Volumen überladen sind.
Hypovoläme Patienten sollten Flüssigkeit bekommen. Die meisten Patienten mit BRASH-Syndrom haben eine Kombination aus Hyperkaliämie und metabolischer Azidose, was isotones Bikarbonat zu einer guten Wahl für die Volumentherapie macht. Wenn das Bikarbonat mittels genügend isotoner Bikarbonatlösung normalisiert werden konnte, sollte die weitere Volumentherapie mit Ringer-Laktat (oder Vollelektrolytlösung) erfolgen. Diese Strategie der sog. pH-geführten Volumentherapie wurde en detail bereits hier besprochen. Kommentar: Ich bin mir sicher, dass auch hiervon in absehbarer Zeit ein Beitrag auf http://www.dasfoam.org zu finden sein wird.
- Kaliurese (+/- Dialyse)
Für die Elimination von Kalium aus dem Körper bedarf es in der Regel Diuretika, welche die Kaliumexkretion in den Urin erleichtern und somit auch zu einer erhöhten Kaliumausscheidung führen. Patienten, die auf die Diuretika nicht mit einer Urinproduktion ansprechen, benötigen eine Dialyse. In der Hoffnung dies verhindern zu können wird der erste Versuch die Diurese zu forcieren häufig aggressiv gefahren:

Fludrokortison kann in Verbindung mit Diuretika ebenfalls die Kaliumausscheidung erleichtern. Dies kann insbesondere bei Patienten hilfreich sein, die Medikamente einnehmen, welche den Aldosteronspiegel herabsetzen (z.B. ACE-Hemmer).
- Katecholamine gegen die Bardykardie und die Schocksymptomatik
Bleibt die hämodynamische Situation des Patienten trotz der o.a. Maßnahmen prekär, ist man häufig versucht abzuwarten und zu schauen, ob sich die Lage nicht doch Stück für Stück entspannt. Aus drei Gründen ist dies Abwarten meistens falsch:
- Die Diuretika können besser wirken, wenn die Nieren auch adäquat perfundiert werden.
- Das Nierenversagen wird schneller aufgehoben, wenn die renale Perfusion sofort wieder stabilisiert wird; vgl. PulmCrit.
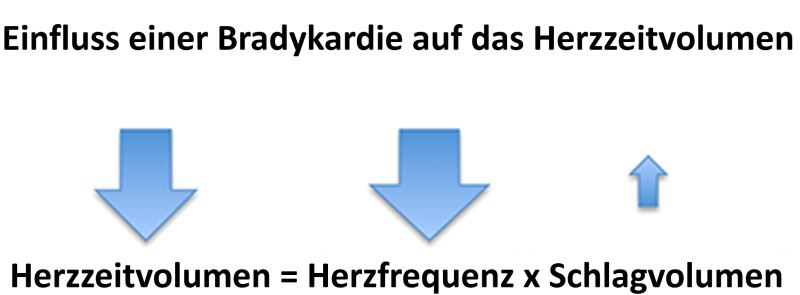
- Verglichen mit der bestehenden Hypotension kann die Hypoperfusion bei Patienten mit einer Bradykardie unverhältnissmäßig ausgeprägt sein. In der Regel reagieren Patienten mit einer Vasokonstriktion, was zu einer Verbesserung des Blutdrucks führt, um eine schwere Bradykardie kompensieren zu können. Der kardiale Auswurf ist durch die weiterhin bestehende Bradykardie aber weiterhin niedrig (vgl. Abbildung 6) .
Bei fortbestehender Instabilität empfiehlt sich eine Katecholamintherapie. Es stehen mehrere Möglichkeiten bei einer bradykardiebedingten Schocksymptomatik zur Verfügung, welche alle wirkungsvoll zu sein scheinen (z.B. Dopamin, Adrenalin und Isoprenalin) . Einige Aspekte von Adrenalin und Isoprenalin sollten nochmals angesprochen werden:
Adrenalin: Wahrscheinlich eine gute Wahl für die kränkeren BRASH-Patienten. Niedrig dosiertes Adrenalin (2-10 mcg/min) stimuliert hauptsächlich β-adrenerge Rezeptoren. Die Aktivierung von β-1-Rezeptoren am Herz wirkt positiv chrono- und inotrop, wohingegen die Stimulation von β-2-Rezeptoren Kalium in die Zelle verschieben und somit die Hyperkaliämie behandeln kann.
Isoprenalin: Hierbei handelt sich um eine gute Option für weniger kranke Patienten ohne zentralen Zugang Kommentar: Wie Josh in einem eigenen Post von 2016 zeigen konnte, ist die periphere Gabe von Katecholaminen zunächst als sicher zu erachten. Bei Isoprenalin handelt es sich um einen nichtselektiven β-Agonisten, was zur Folge hat, dass es das Herz stimuliert und Kalium in die Zellen verschiebt (allerdings mit geringerem Effekt auf das Kalium als Adrenalin) . Der Vorteil von Isoprenalin liegt darin, dass es keine vasokonstriktiven Eigenschaften besitzt, was zu einer sicheren Alternative für die periphere i.v.-Gabe macht .
In der Regel unnötige Behandlungen
Erweiterte Maßnahmen hinsichtlich der β- oder Kalziumkanalblocker-Intoxikation: Patienten mit einem BRASH-Syndrom haben meisten keine schwerwiegend hohen Level an β- oder Kalziumkanalblockern. Dementsprechend sprechen sie auf die o.a. Katecholamintherapie wahrscheinlich an. Ich musste bisher nur einen Patienten mit hoch dosierter Insulintherapie und Lipid-Rescue in einer solchen Situation behandeln (er hatte ein paroxysmales Vorhofflimmern und erhielt die maximale Dosis an β- und Kalziumkanalblockern gleichzeitig).
Glukagon: Diese Therapie ist für diese Patienten aus zwei Gründen eher suboptimal: Erstens führt es häufig zu Erbrechen und ist nicht konstant effektiv. Zweitens, wenn es wirkt, ist es auch nur eine kurzfristige Lösung. Diese Patienten brauchen allerdings häufig eine Therapie über 12-24 Stunden, so dass eine Infusion mit Katecholaminen oder Milrinon allein aus logistischen Gründen gewinnbringender erscheint .
Transvenöses Pacing: Das BRASH-Syndrom ist ein metabolisch / toxikologisches Problem, was fast immer auf eine aggressive medikamentöse Therapie anspricht. Notfallmäßiges transvenöses Pacing ist in der Regel unnötig (so ist z.B. intravenöses Kalzium sicherer, schneller und effektiver).
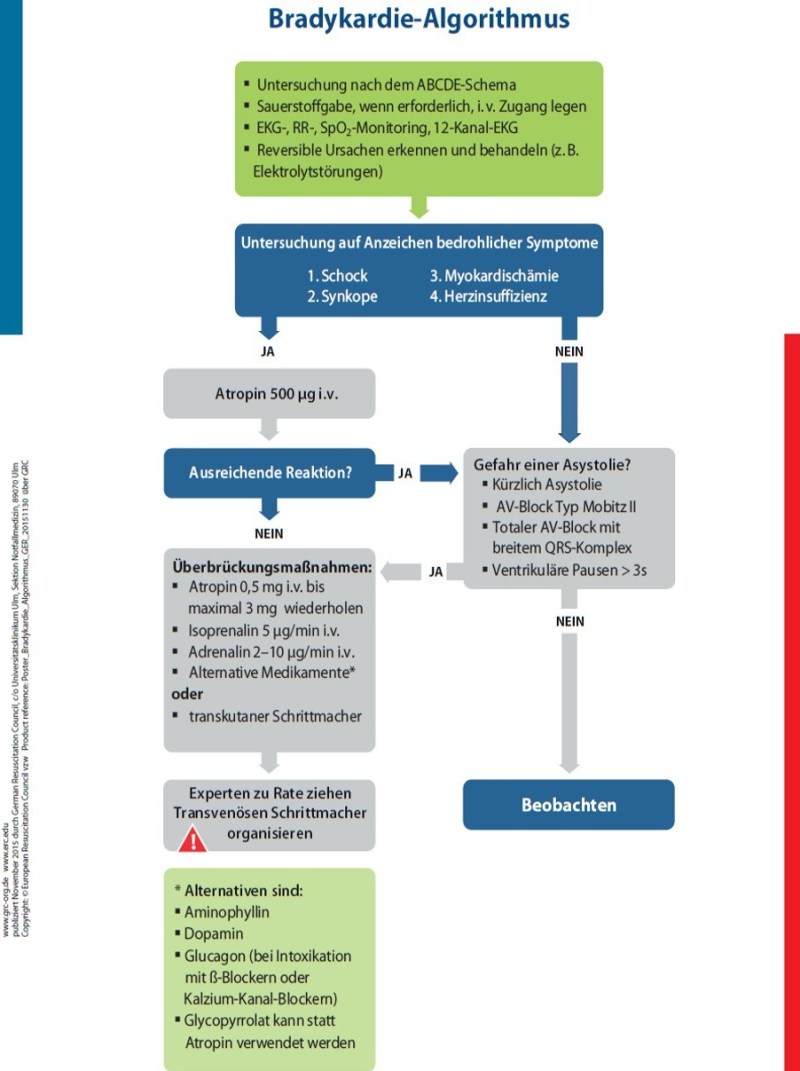
ALS: Der ALS Bradykardie-Algorithmus (vgl. Abbildung 7) greift bei einem BRASH-Syndrom nur eingeschränkt. Einige Patienten werden auf Atropin oder transkutanes Pacing nicht adäquat ansprechen, allerdings auf intravenöses Kalzium. Folgt man blindlings dem ALS-Algorithmus, besteht die Gefahr zu häufig auf transvenöses Pacing zurückzugreifen zu müssen .
- Das BRASH-Syndrom bezieht sich auf einen Teufelskreis, der eintreten kann, wenn Patienten, die AV-Knoten-Blocker einnehmen, eine Niereninsuffizienz mit einer Hyperkaliämie entwickeln. Dies führt zu einer Spirale mit Verschlechterung der Hyperkaliämie, der Niereninsuffizienz und einer bradykardiebedingten Schocksymptomatik (vgl. Abbildung 8).
- Ein BRASH-Syndrom kann durch eine Dehydratation, eine medikamentöse Aufdosierung oder jegliche andere Ursache einer Hypoperfusion oder renalen Dysfunktion ausgelöst werden.
- Die Behandlung des BRASH-Syndroms fokussiert sich auf die aggressive Therapie der Hyperkaliämie. Zusätzlich benötigen viele Patienten eine Katecholamintherapie, um die Perfusion aufrechterhalten zu können.

Verwandte Themen und Beiträge
- Hyperkaliämie
- Management of severe hyperkalemia (PulmCrit) und hier als freie Übersetzung.
- Treatment of severe hyperkalemia (EMCrit 2010)
- Wahl der richtigen Infusionslösung
- pH-guided resuscitation (PulmCrit)
- LR is safe in hyperkalemia (PulmCrit) und hier als freie Übersetzung.
Anmerkungen
Mein erster Fall eines BRASH-Syndroms war gleich einer der schwereren Fälle, die ich behandelt habe: Eine 80-jährige Dame stellte sich mit einem Lungenödem, Nierenversagen und Schocksymptomatik vor, so dass sie beatmet werden musste und hoch dosierte Vasopressoren erhielt. Die Ätiologie ihres Multiorganversagens war unklar und zu Beginn sah es wie ein hoffnungsloser Fall aus. Trotzdem erholte sie sich dank aggressiver, unterstützender Therapie vollständig. Erst nachdem alle anderen Möglichkeiten ausgeschlossen worden waren, konnte retrospektiv eine Anhäufung des β-Blockers als Ursache ausgemacht werden.
Eine Intoxikation mit Digoxin kann auf nahezu identischem Wege eintreten, mit einem Teufelskreis aus progredienter Niereninsuffizienz und Digoxinakkumulation. Da die Diagnose und Behandlung der Digoxinintoxikation sich aber deutlich unterscheidet, wird sie hier nicht mit eingeschlossen.
Die Literaturhinweise für die Tabelle lauten wie folgt: Aziz et al 2011, Erden et al 2010, Unterman et al 2008, Isabel et al 2006, Bonvini et al 2006, Vuckovic et al 2004, Zimmers et al 2002, Vazquez et al 1996, Jolly et al 1991, Lee et al 1986.
Es gibt Berichte von Patienten mit einer leichten Hyperkaliämie und einem Leitungsblock. Ich vermute, dass diese Patienten eine bereits vorbestehende Problematik in ihrem Reizweiterleitungssystem haben; aber das ist nur eine Vermutung.
Diese Patienten reagieren im Grunde ähnlich wie septische Patienten, die mit hohen Dosen Phenylephrin (Kommentar: Im deutschsprachigen Raum ist Phenylephrin lediglich als Zusatz in Augentropfen oder Nasenspray vorhanden, allerdings nicht zur parenteralen Gabe zur Blutdrucksteigerung.) behandelt werden, einem reinen Vasokonstriktor. Die Vasokonstriktion verbessert zwar den Blutdruck, kann aber im Gegenzug durch die Erhöhung der kardialen Nachlast die systemische Perfusion sogar verschlechtern. Somit verursacht die überhöhte Vasokonstriktion eine Situation, in der der Blutdruck singulär betrachtet in Ordnung ist, der Patient aber eigentlich substantiell minderperfundiert wird. Klinisch kann man das an kalten Extremitäten und verminderter Urinproduktion sehen.
Es ist möglich, dass eine Bradykardie nur auf eine Kombination aus Katecholaminen und Kalzium anspricht. Sollte es sich um eine katecholaminrefraktäre Bradykardie handeln, ist die zusätzliche Kalziumgabe zu erwägen.
Bei Leveln mit vergleichbarer Stimulation von β-1-Rezeptoren, scheint Adrenalin einen größeren Effekt auf die β-2-Rezeptoren und den Kaliumspiegel zu haben . Obwohl Isoprenalin ebenfalls in der Lage ist eine Hypokaliämie zu verursachen, scheint dieser Effekt bei der Dosierung, welche für die Bradykardiebehandlung gegeben wird, klinisch nicht relevant zu sein.
Auf PubMed sind keine Fallberichte von Hautnekrosen aufgrund einer Isoprenalininfusion zu finden. Da Isoprenalin sogar eine Vasodilatation verursacht, wurde es in Tierversuchen als Antidot zur Behandlung von Extravasationsreaktionen getestet. Zahlreiche Referenzen zeigen, dass Isoprenalin peripher gegeben werden kann (z.B. Alfred ICU, Critical Care Study Guide von Criner GJ et al. und Critical Heart Disease in Infants and Children von Nichols DG et al.). Dadurch, dass Isoprenalin keine Vasokonstriktiven Eigenschaften besitzt, besteht theoretisch die Möglichkeit, dass es zu einer Abnahme des Blutdrucks kommen kann, bedingt durch die periphere Vasodilatation. Im Ganzen scheint die chronotrope und inotrope Wirkung von Isoprenalin diesen vasodilatativen Effekt zu überwiegen. Nichtsdestotrotz ist Adrenalin für deutlich hypotensive Patienten sicher die besser Wahl im Gegensatz zu Isoprenalin. Wenn Unsicherheit besteht, kann vorsichtig mit Isoprenalin begonnen werden und mit zusätzlich bereitstehenden Medikamenten (z.B. Adrenalin) entgegengesteuert werden, falls es zu einem Blutdruckabfall kommen sollte.
Die kontinuierliche Gabe mittels eines Glukagonperfusors ist möglich, allerdings zeigte sich die Apotheke dieser Idee nicht wirklich offen (z.B. würde es den gesamten Glukagonvorrat des Krankenhauses aufbrauchen). Glukagon kann den myokardialen cAMP-Spiegel unter Umgehung der β-Rezeptoren erhöhen. Milrinon hat einen ähnlichen Effekt und ist allein vom logistischen Standpunkt die besser Wahl, um dies zu erreichen.
Versteht irgendjemand warum intravenöses Kalzium nicht in den Bradykardie-Algorithmus implementiert wurde? Der einzige Grund, den ich mir vorstellen könnte, ist die Sorge bzgl. eines sog. Steinherzens, einem (fragwürdigen) Phänomen, was wohl u.a. durch die Kalziumgabe bei Patienten mit Digoxinintoxikation auftreten kann. Nach Nichtansprechen auf Atropin oder Katecholamine sollte intravenöses Kalzium und Lipid-Rescue als denkbare dritte bzw. vierte Strategie in Erwägung gezogen werden.
Titelbild und Abbildung 8: BRASH-Syndrom von Hanson’s Anatomy, mit freundlicher Genehmigung der Zeichnerin. Weitere Infos zu diesen wunderbaren, farbenfrohen Illustrationen findet ihr hier.


Hier wird Ringer-Lactat angegeben. Ist das mit nem Hintergrund oder funktioniert das in meinen Breiten üblichere RingerAcetat auch?
Hallo Henrik,
primär geht es darum auf NaCl 0,9% zur Volumentherapie zu Gunsten einer balanzierteren (Voll-)Elektrolytlösung zu verzichten. Wie in einem aktuelleren Beitrag von Josh nochmal hervorgehoben wird (https://emcrit.org/pulmcrit/smart/), ist er ein großer Freund von Ringer-Laktat, da es in seinen Augen möglicherweise sogar zu einer verbesserten kardialen Funktion führen kann; demgegenüber gibt es aber sicher genau so gute Gründe Ringer-Acetat zu bevorzugen, da es Hinweise gibt, dass hierunter der hepatische Sauerstoffverbrauch deutlich geringer ist (https://www.notfallmedizin.blog/infusion.html). Wie so oft liegt die Wahrheit, frei nach Dschalal ad-Din al-Rumi, wohl immer irgendwo zwischen richtig und falsch. Wir werden in nächster Zeit auf die Ergebnisse der SMART-Studie auch nochmal in 2 Posts genauer eingehen.