Man könnte diesen Artikel damit beginnen darüber zu philosophieren, dass die Hyponatriämie die häufigste Elektrolytstörung ist und mit langweiligen Zahlen werfen. Aber jedem, der eine Weile in der Akutversorgung gearbeitet hat, ist sicherlich schon aufgefallen wie häufig Hyponatriämien auftreten. Sparen wir uns also das Vorgeplänkel, denn wir haben viel vor:
Zunächst muss man grundsätzlich verstehen, wie es zur Entwicklung einer Hyponatriämie kommt und welche Ursachen es gibt, da sich die Therapie (und vor allem auch die Gefahren durch die Therapie) stark unterscheiden. Ihr erinnert euch dunkel: Primum non nocere!
Falscher Alarm? Die “Pseudohyponatriämie”
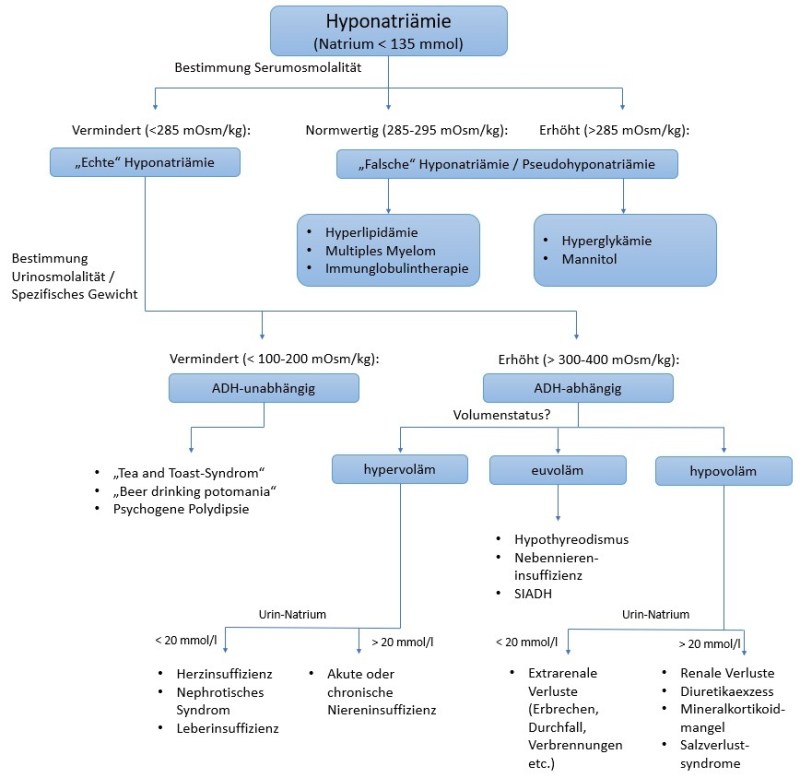
Im ersten Schritt gilt es, „echte“ von „falschen“ Hyponatriämien (Pseudohyponatriämie) zu unterscheiden. Hierfür reicht eine Bestimmung der Serum-Osmolalität aus.
Bei erhöhten Werten liegt im Serum ein osmotisch aktiver Stoff vor, welcher zu einer Verschiebung von Wasser nach intravasal führt und somit die Natriumkonzentration senkt, ohne dass absolut weniger Natrium vorhanden wäre. Für erhöhte Blutzuckerwerte (die mit Abstand häufigste Ursache der hypertonen Hyponatriämie) kann man schnell und unkompliziert das „korrigierte Natrium“ berechnen (pro 5,5 mmol BZ Korrektur des Natriums um ca. 2 mmol nach oben - oder einfach in einer Kalkulator-App Eurer Wahl, z.B. hier) und feststellen, dass in Wirklichkeit gar keine Hyponatriämie vorliegt.
Bei normwertiger Osmolalität trägt das Labor möglicherweise die “Schuld” für das scheinbar niedrige Natrium – zumindest, wenn das Natrium im Serum bestimmt wurde. Hierbei kommt nämlich eine indirekte Messmethode zum Einsatz. Das Labor misst die Konzentration im Plasma anhand von verdünnten Proben mit automatisierten ionensensitiven Elektroden. Im Anschluss wird die Verdünnung korrigiert und zwar unter der Annahme, dass das Plasma zu 93% aus Wasser besteht. Das ist aber nicht immer der Fall. Insbesondere bei Lipidstoffwechselstörungen kann der Anteil des Wassers im Plasma zu einem nicht unerheblichen Teil durch Lipide reduziert sein. Ähnliches kann beim Vorliegen von übermäßig viel Protein im Plasma der Fall sein (z. B. im Rahmen eines multiplen Myeloms oder nach Immunglobulintherapie). Wie kann man dieses Problem umgehen? Durch Natrium-Bestimmung mittels direkt messender ionensensitiver Elektrode oder einfacher ausgedrückt: mit einer simplen BGA (und ja, es tut definitiv auch eine venöse BGA - tut es übrigens fast immer, aber das ist ein anderes Thema).
It’s all about the wee: ADH und die Urinosmolalität
Im Fall einer echten Hyponatriämie gilt es als nächstes zu klären, ob es sich um eine ADH-unabhängige oder eine ADH-abhängige Hyponatriämie handelt. Hierfür kann uns die Osmolalität des Urins (UOSM) behilflich sein. (Kommentar: Die UOSM ist wie viele andere Tests leider nicht 100% sensitiv und spezifisch, was man daran merkt, dass immer eher grobe Bereiche für die Einteilung in ADH-abhängig vs. -unabhängig angegeben werden. Für das Grundverständnis ist es aber unabdingbar!)
Bei den ADH-unabhängigen Formen ist die ADH-Aktivität bei den Patienten extrem gering und die UOSM somit (sehr) niedrig (< 100-200 mOsm/kg H2O). Wenn die Patienten so viel freies Wasser ausscheiden (niedrige UOSM = hohe free water clearance), wie kann es dann trotzdem zur Entwicklung einer Hyponatriämie kommen?
Hierzu müssen wir (leider) kurz in die Nierenphysiologie abtauchen. Eine gesunde Niere kann die Urinosmolalität maximal im Bereich von 50 – 1200 mOsm/kg H2O „einstellen“ und somit die Serumosmolalität, auch bei wechselnder oraler Flüssigkeitsaufnahme, konstant halten. Um Urin herzustellen braucht der Körper aber auch immer lösliche Stoffe: die renal solute load – renale Molenlast (wir haben schon tolle Wörter in der deutschen Sprache), die er zusammen mit freiem Wasser ausscheiden kann. Die durchschnittliche renale Molenlast liegt bei ausgewogener Ernährung bei 10 mOsm/kg KG/Tag (ca. zur Hälfte Elektrolyte und zur anderen Hälfte Harnstoff). Bei einer UOSM von 50 mOsm/l könnte eine 70 kg schwere Person (=700 mOsm Molenlast) also maximal 14 Liter Urin produzieren. Somit müsste diese Person mehr als 14 Liter am Tag trinken um eine Hyponatriämie zu entwickeln. Wenn die renale Molenlast aber nur bei zum Beispiel 200 mOsm läge, was im Rahmen einer einseitigen Ernährung (Stichwort Tea-and-Toast-Syndrom oder Beer-drinking-potomania) möglich ist, könnten die Nieren schon nur noch maximal vier Liter Urin produzieren (200/50=4). Ab einer Flüssigkeitsaufnahme von fünf Litern würde es rechnerisch also bereits zu einer Hyponatriämie kommen (wie viel Bier schafft ihr so in 24 Stunden?).
Die ADH-unabhängige Hyponatriämie entsteht also auf Grund eines Mangels an löslichen Stoffen, die (oral) aufgenommen werden (= renale Molenlast). Bei Patienten mit einer psychogenen Polydipsie besteht ein relativer Mangel (an sich genug Molenlast, aber zu viel Wasseraufnahme). Bei Patienten mit Tea-and-Toast-Syndrom oder der „Bier-Trunksucht“ besteht ein absoluter Mangel an Molenlast bei nicht unbedingt exzessiver Flüssigkeitsaufnahme. Überlappungen zwischen den Krankheitsbildern sind sicherlich häufig und nicht immer ist eine klare Abgrenzung möglich oder sinnvoll.
Kommen wir nun zu den ADH-abhängigen Formen. Auf Grund der erhöhten ADH-Aktivität liegt eine höhere Urin-Konzentration (>200-300 mOsm/kg H2O) vor. Auch hier ist es wieder nicht möglich einen definitiven Cutoff festzulegen. Ein Vergleich mit der Serum-Osmolalität ist zum Verständnis sicherlich sinnvoll. So lange die UOSM unterhalb der Serum-Osmolalität liegt, versucht der Körper freies Wasser auszuscheiden. Somit kann keine nennenswerte ADH-Aktivität vorliegen. Liegt die UOSM oberhalb der Serum-Osmolalität wird aktiv freies Wasser zurückgehalten, was nur unter dem Einfluss von ADH möglich ist.
ADH-abhängige Hyponatriämien: Wie steht’s um den Volumenstatus?
Als wäre es bisher nicht schon kompliziert genug, werden die ADH-abhängigen Formen in Abhängigkeit vom Volumenstatus nun auch noch in drei Untergruppen eingeteilt (hypovoläm, euvoläm und hypervoläm).
Die hypervoläme Hyponatriämie ist vermutlich noch am einfachsten zu erkennen, z.B. bei Ödemen, Pleuraerguss, Ascites und - weil in jedem dasFOAM-Artikel Ultraschall gepriesen werden muss - venöser Kongestion nach VExUS-Score.

Hierbei kommt es auf Grund einer Fehlverteilung mit effektiv zu wenig arteriellem Blutvolumen zu einer vermehrten Freisetzung von ADH. Zu finden ist diese Art der Hyponatriämie daher typischerweise bei den Krankheitsbildern (dekompensierte) Herzinsuffizienz sowie Leberzirrhose, dem nephrotischen Syndrom und allgemein der akuten oder chronischen Niereninsuffizienz. Die Konzentration von Natrium im Urin kann eine weitere Unterteilung ermöglichen. Im Rahmen der Herz- und Leberinzuffizienz sowie beim nephrotischen Syndrom ist die Konzentrationsfähigkeit der Niere gegeben, sodass die allgemeine RAAS-Aktivierung im Rahmen dieser Grunderkrankungen zu einer verstärkten Natrium-Resorption führt. Dies spiegelt sich in einer geringen Natrium-Konzentration im Urin wider (<30 mmol/l). Im Rahmen der akuten oder chronischen Niereninsuffizienz liegt die Urin-Na+ Konzentration in der Regel über 30 mmol/l. Je nach Quelle wird diese Art der Hyponatriämie gelegentlich auch den ADH-unabhängigen Formen zugeordnet (siehe Flow-Chart unten).
Insgesamt ist gerade unter Einnahme von Diuretika die absolute Natrium-Konzentration im Urin kritisch zu sehen und dann häufig „falsch“ hoch.
Große Schwierigkeit bereitet die Unterscheidung zwischen hypo- und euvolämer Hyponatriämie. Hierzu gibt es eine schöne Arbeit von Chung et al (bereits 1987!). Hier wurde der Volumenstatus von Patienten mit Hyponatriämie ohne Ödeme klinisch (durch „erfahrene“ Kliniker) und laborchemisch (Urin-Natrium, Renin, Kreatinin, Harnstoff) untersucht. Im Anschluss erhielten alle Patienten parenteral NaCl 0,9%. Kam es hierunter zu einem suffizienten Anstieg (>= 5 mmol) des Serum-Natriums wurden die Patienten als hypovoläme Hyponatriämien gewertet, bei fehlendem Anstieg als euvoläme. Die Wahrscheinlichkeit, dass die erfahrenen Kliniker die hypovolämen Patienten richtig erkannten, lag bei 47% - etwas schlechter als ein Münzwurf. Alle klinischen Untersuchungsmethoden (Blutdruck stehend/liegend, Herzfrequenz stehend/liegend, Hautturgor, Feuchte der Schleimhäute etc.) waren nicht signifikant unterschiedlich in den beiden Gruppen. Im Vergleich dazu waren alle laborchemischen Marker in den Gruppen signifikant unterschiedlich. Die beste Spezifität (100%) und Sensitivität (80%) zur Vorhersage, ob die Hyponatriämie auf Flüssigkeitsgabe ansprechen würde (und somit als hypovoläme Hyponatriämie klassifiziert werden kann), hatte die Urin-Natrium-Konzentration <30 mmol/l.
Nach diesen wenig ermunternden Worten für die Tugend der sorgfältigen klinischen Untersuchung zurück zur Ätiologie der euvolämen und hypovolämen Hyponatriämien.
Die häufigste Ursache für die euvoläme Hyponatriämie ist das Syndrom der inadäquaten ADH-Sekretion (SIADH). Der Name führt immer wieder zu Verwirrungen. Bei diesem Krankheitsbild wird inadäquat zu viel ADH ausgeschüttet, sodass es zu einer übermäßigen Rückresorption von freiem Wasser und somit zur Entstehung einer Hyponatriämie kommt. Auslöser sind vielfältig und oft auch nur vorübergehend. So kann es transient zum Beispiel im Rahmen von Schmerzen, Stress, Übelkeit und Erbrechen, Überdruckbeatmung und vielem mehr zu einer vermehrten ADH-Freisetzung kommen. Es ist also nicht immer das kleinzellige Bronchialkarzinom, das sich noch versteckt hält. Auch verschiedene Pharmaka sind als Ursachen zu nennen, z.B. SSRI, Neuroleptika, NSAR, Trizyklische Antidepressiva, MDMA und viele mehr. Weitere häufige Gründe sind pulmonale Erkrankungen (z. B. Pneumonie) oder ZNS-Erkrankungen (Infektionen, Blutungen, Tumore etc.). Durch die ständige ADH-Aktivität ist der Urin bei den erkrankten Personen durchweg (zu) hoch konzentriert. Ein Rechenbeispiel: Die Urinosmolalität beträgt 600 mOsm/l, die Beispielpatientin wiegt 60 kg und hat eine renale Molenlast von 600 mOsm/l am Tag. Damit könnte die Beispielpatientin nur einen Liter Urin pro Tag produzieren. Somit trägt jede zusätzliche Wasseraufnahme über diesen Liter hinaus (Perspiratio insensibilis nicht berücksichtigt) zur Entstehung bzw. Verschlimmerung der Hyponatriämie bei. Weitere Ursachen für eine euvoläme Hyponatriämie wären ein Cortisolmangel bei Nebennierenrindeninsuffizienz (CAVE: nicht Mineralokortikoidmangel) und eine Hypothyreose.
Bei der hypovolämen Hyponatriämie ist die zu Grunde liegende Pathophysiologie eine erhöhte ADH-Freisetzung auf Grund einer verminderten Perfusion der Peripherie. Hierüber soll erhöhtes intravasales Volumen generiert werden. Die Serum-Osmolalität ist in diesem Fall nachrangig. Man kann zunächst über die Urin-Natrium-Konzentration (< bzw. >30 mmol/l) herausfinden, ob es sich um extrarenale Wasserverluste handelt oder nicht. Niedriges Urin-Natrium spricht für extrarenale Verluste z. B. im Rahmen von Durchfall, Erbrechen, Verbrennungen, Pankreatitis usw. Höhere Natriumkonzentrationen im Urin sprechen für die Unfähigkeit der Nieren ausreichend Natrium zurück zu halten. Dies ist häufig unter Diuretikatherapie (eher Thiazide als Schleifendiuretika, da die Schleifendiuretika über eine Abschwächung des Gegenstromprinzips seltener Hyponatriämien auslösen, Stichwort gestörter Konzentrationsmechanismus), bei Mineralokortikoidmangel (CAVE: bei gleichzeitig erhöhtem Kalium und niedrigem RR an Addison-Krise denken!), bei Salzverlustsyndromen (renale und cerebrale, wenn es letztere denn überhaupt gibt) und im Rahmen von osmotischer Diurese zu beobachten.
Management der Hyponatriämie: Primum non nocere!
So viel zur Pathophysiologie, aber Fortbildung soll ja handlungsrelevant sein. Kommen wir also zu den Therapieprinzipien und vor allem den Gefahren durch die Therapien. Beginnen wir mit ein paar grundlegenden Überlegungen. Was passiert pathophysiologisch, wenn man den verschiedenen Formen der Hyponatriämie 1000 ml Vollelektrolytlösung gibt?
(Anm: die Pseudohyponatriämie berücksichtigen wir ab jetzt nicht mehr, denn die wollen wir ja nicht behandeln und auch der hypervolämen Hyponatriämie gibt hoffentlich niemand noch mehr Wasser. Nein, auch nicht bei aktuell höherem Kreatinin als im Voraufenthalt und bitte erst recht nicht zusammen mit einem Schleifendiuretikum zur “Nierenspülung”.)
- ADH-unabhängig: Grundproblem ist die zu geringe renale Molenlast (z. B. 100 mOsm/Tag). Hiermit könnten maximal 2 Liter Urin produziert werden (50 mOsm/l). Bei Gabe von 1000 ml Vollelektrolytlösung (~290 mOsm/l), erhalten die Nieren auf einmal 290 mOsm zum Ausscheiden. Das ergibt bei einer Urin-Konzentration von 50 mOsm/l eine Urinmenge von 5,8 Liter bei einer Einfuhr von nur 1000 ml. Somit werden 4,8 Liter freies Wasser ausgeschieden. Dies kann bei einer zu großzügigen Gabe von Flüssigkeit zu einem zu schnellen Anstieg führen.
- SIADH: Durch inadäquate ADH-Freisetzung „fixierte“ Urinosmolalität (z. B. bei 600 mOsm/l). Bei Gabe von 1000 ml Vollelektrolytlösung (~290 mOsm/l), also einer Tonizität unterhalb der Urinosmolalität, kann es zu einem weiteren Abfall des Serum-Natriums kommen. Von den 1000 ml VEL können nur rund 500 ml bei der fixen Urinosmolalität ausgeschieden werden (290/600 = 0,485).
- Hypovoläme Hyponatriämie: Hier müssen wir zum Glück nichts rechnen. Die Gabe von Flüssigkeit hebt die Hypovolämie auf, somit fällt dieser Reiz für die ADH-Freisetzung weg. Daraufhin bleibt nur noch die Osmolalität als Regelmechanismus für die ADH-Freisetzung. Die Osmolalität ist nun aber sehr niedrig, sodass die ADH-Produktion nahezu vollständig eingestellt wird. Somit kommt es plötzlich zu einer starken Diurese mit einer Ausscheidung von viel freiem Wasser und somit zum Anstieg des Serum-Natriums. Bei zu schnellem Ausgleich der Hypovolämie kann somit ein überschießender Anstieg des Natriums drohen.
Das sind natürlich geschönte Beispielrechnungen, in vivo gibt es reichlich Störfaktoren, die das Ergebnis beeinflussen. Für das Verständnis finde ich die Überlegung dennoch hilfreich. Was fällt uns bei Betrachtung dieser drei Szenarien auf? Die Gefahr der Überkorrektur liegt oft in der Therapie an sich. Und sowohl die hypovoläme als auch die ADH-unabhängige Hyponatriämie bessern sich durch Flüssigkeitsgabe. Deshalb ist es umso wichtiger vor Einleitung der Therapie die Ursache der Hyponatriämie zu klären. Doof wäre es nämlich, wenn man der Patientin mit dem “Tea and Toast Syndrom” (welche sowie so schon relativ zu viel Wasser zu sich nimmt) sagt, dass sie doch bitte mehr trinken soll (weil man selbst die Hyponatriämie fälschlicherweise als hypovoläm und nicht als ADH-unabhängig gewertet hat).
Bevor wir also die genaue Therapie besprechen müssen wir noch einmal einen Schritt zurück gehen und darüber reden, warum es überhaupt notwendig ist zu therapieren bzw. was die konkrete Gefahr der Therapie ist.
In der Notaufnahme werden uns zwei Patientengruppen begegnen. Die einen sind komplett asymptomatisch (zum Teil auch bei absurd niedrigen Natriumwerten) und die anderen sind symptomatisch. Die Symptome können von leichten, unspezifischen Symptomen wie Kopfschmerzen, Übelkeit und Erbrechen bis hin zu Krampfanfällen, Koma und nicht-kardialen Lungenödemen reichen. Die Höhe des aktuellen Natriums ist hierbei nicht wirklich hilfreich. Die kleine, alte Dame, die seit Monaten mit Hilfe ihres HCT auf eine ausgeprägte Hyponatriämie mit 115 mmol/l hingearbeitet hat, kann völlig beschwerdefrei sein. Der 24-jährige Student, der im Rahmen einer Mutprobe innerhalb kürzester Zeit 5 Liter Wasser getrunken hat, kann dagegen mit einem Natrium von 122 mmol/l im Status epilepticus vorgestellt werden. Bei der alten Dame müssen wir langfristig die Hyponatriämie beseitigen, weil diese zu vermehrten Stürzen und Frakturen (zum einen durch die Stürze selbst, zum anderen durch eine Störung des Knochenstoffwechsels im Rahme der Hyponatriämie) und in der Folge auch zu einer erhöhten Mortalität führt (Kuo et al, Usala et al, Corona et al). Allerdings wäre hier eine schnelle Korrektur des Natriums bei fehlenden akuten neurologischen Symptomen nicht sinnvoll und mit einem hohen Komplikationsrisiko verbunden.
Anders sieht es bei dem krampfenden Studenten aus. Was passiert da pathophysiologisch? Ein akuter Abfall der Serumosmolalität (überwiegend durch die Natrium-Konzentration bestimmt) führt dazu, dass Zellen, die ihre intrazelluläre Osmolalität nicht so schnell ändern können, freies Wasser von extrazellulär aufnehmen. In den meisten Geweben ist das nicht weiter problematisch, beim Gehirn sieht das allerdings anders aus. Wenn die Osmolalität des Serums schnell abfällt, beginnen die Gehirnzellen zunächst Elektrolyte abzugeben (v.a. Natrium, Kalium und Chlorid). Im weiteren Verlauf werden auch kleine organische Osmolyte abgegeben (v.a. Amionosäuren wie Glutamat und Glycin) (Giuliani et al) . Ziel hierbei ist es, intrazellulär die gleiche Tonizität wie im Blut zu erreichen, damit es netto zu keiner Verschiebung von Wasser kommt. Der Anpassungsprozess des Gehirns ist allerdings verhältnismäßig langsam. Kommt es also zu abrupten Änderungen droht die Verschiebung von freiem Wasser. Wenn das Natrium zu schnell fällt nehmen die Zellen Wasser auf, schwellen dadurch an und es kann zum Hirnödem kommen. Wenn das Natrium zu schnell steigt verlieren die Zellen freies Wasser und es kann zu einer osmotischen Demyelinisierung kommen (Anm: ich hab’ in der Uni immer noch den Begriff der “pontinen Myelinolyse” gelernt. Da dieser Prozess aber nicht isoliert im Pons ablaufen muss wird hier der allgemeinere Name verwendet).
Ein unterschätztes Problem: Die hyponatriämische Enzephalopathie
Der akute Abfall des Natriums führt also zur Ausbildung eines Hirnödems und somit zum Krankheitsbild der hyponatriämischen Enzephalopathie, welches sich in den oben genannten Symptomen (Übelkeit und Erbrechen, Vigilanzminderung, Krampfanfälle etc.) widerspiegelt. Da bei schweren Symptomen die Letalität der Hyponatriämie immens ist, ist es notwendig das Natrium in den ersten ein bis zwei Stunden um 5-6 mmol/l anzuheben. Hierfür empfiehlt die europäische Leitlinie für Hyponatriämie die Gabe von 150 ml einer 3%-igen NaCl Lösung und ggf. wiederholte Gaben bis zum Erreichen des gewünschten Anstiegs (Ziel: Anstieg um 5 mmol/l), erst danach soll eine spezifische Therapie abhängig von der Ätiologie eingeleitet werden.
Leider ist NaCl 3% in Deutschland nicht verfügbar. Man könnte also alternativ eine 5,85%-Lösung auf nahezu 3% verdünnen (90 ml NaCl 0,9% und 60 ml NaCl 5,85% ergeben rechnerisch ca. 2,9%) oder alternativ einen auf 100 ml reduzierten Bolus NaCl 5,85% geben und im Anschluss das Serumnatrium kontrollieren. Andere Autoren erinnern an den hohen Natrium-Gehalt von Natrium-Bicarbonat 8,4% Lösungen (1 mmol/ml) und schlagen anstelle von hypertoner Kochsalzlösung die Gabe von 1-2 Boli von je 100 ml NaBic 8,4% vor.
Es besteht immer wieder (unbegründete) Angst vor der Anwendung von hypertoner NaCl-Lösung. Zeit für ein dasFOAM-Mythbusting:
- “Hypertone NaCl-Lösung darf nur zentral gegeben werden”
Nein, auch die periphervenöse Gabe ist sicher (Perez 2017, Ryan 2018, Dillon 2018, Mesghali 2019) - “Die Patienten bekommen nach Gabe von hypertoner Kochsalzlösung sehr häufige eine osmotische Demyelinisierung (OD).”
Nein, es gibt verschiedene Beobachtungsstudien, die ein nur geringes Risiko für eine OD beschreiben. Beispielsweise sei hier z.B. die Veröffentlichung von George et al aus 2018 genannt: hier wurden 1490 Patienten mit einer Hyponatriämie beobachtet. 41% hatten eine Überkorrektur >10 mmol in den ersten 24 Stunden. Von diesen mehr als 600 Patienten mit Überkorrektur erlitten lediglich neun eine OD. Hiervon haben sich fünf vollständig erholt, zwei sind auf Grund anderer Ursachen verstorben und zwei im follow-up verloren gegangen. - “Die Hyponatriämie bzw. die hyponaträmische Enzephalopathie (HE) ist doch nicht soo schlimm.”
Nein, in vielen Studien ist die Letalität von Patienten mit Hyponatriämien immens (und das liegt sicher nicht an der eher seltenen OD).- Diese Studie aus 1999 beschäftigt sich mit chronischer-hyponatriämer Enzephalopathie bei postmenopausalen Frauen (kleine Studie, 53 Patientinnen in 3 Gruppen):
- 1. Gruppe: bei Diagnose der HE direkt hypertones NaCl - von 17 Patientinnen haben sich alle neurologisch vollständig erholt
- 2. Gruppe: hypertones NaCl verzögert gegeben (nach Intubation) - von 22 Patientinnen waren acht danach noch selbstständig, der Rest konnten kein selbstständiges Leben mehr führen oder ist verstorben
- 3. Gruppe: kein hypertones NaCl, nur Flüssigkeitsrestriktion - von 14 Patientinnen verstarben 11 (10 in den ersten 24 Stunden), keine einzige Patientin hatte ein gutes neurologisches Outcome
- Diese Studie aus 1999 beschäftigt sich mit chronischer-hyponatriämer Enzephalopathie bei postmenopausalen Frauen (kleine Studie, 53 Patientinnen in 3 Gruppen):
Daily Business in der ZNA: Labor auffällig, aber kaum Symptome?
Bei der asymptomatischen Hyponatriämie sieht die Therapie anders aus. Hier ist weniger oft mehr, da die Gefahr der Hyponatriämie vor allem in ihrer Therapie liegt. Der Ausgleich des Natriums sollte spezifisch je nach Ätiologie der Hyponatriämie erfolgen. Hierfür ist es sinnvoll die komplette Diagnostik (Serum: Osmolalität, Kreatinin, Harnstoff, Harnsäure, Natrium, Kalium, venöse BGA; Urin: Status, Osmolalität, Kreatinin, Natrium, Harnsäure) abzuwarten bevor man weitere Maßnahmen ergreift (das schließt auch scheinbar banale Maßnahmen wie 1000 ml Vollelektrolytlösung mit ein).
1. ADH-unabhängige Hyponatriämie (insb. Tea-and-Toast-Syndrom und Bier-Potomanie):
- Optimierung der Ernährung (Protein- und salzreiche Kost) zur Erhöhung der renalen Molenlast
- Zeitweise ggf. Erhöhung der renalen Molenlast durch die Gabe von Harnstoff-Mischung (falls vorhanden, sonst Kochsalztabletten)
2. Hypervoläme Hyponatriämie
- Behandlung der Grunderkrankung, i.d.R. mittels diuretischer Therapie, ggf. Dialyse
- Spezifische Therapien (Ursache der kardialen Dekompensation beheben, nephrologisches Konsil bei Verdacht auf hydropische Dekompensation bei Niereninsuffizienz)
3. Euvoläme Hyponatriämie
- Nebenniereninsuffizienz: insb. bei dauerhafter Glucocorticoideinnahme (Substitution anpassen!)
- SIADH: primär i.d.R. Flüssigkeitsrestriktion (800 - 1000 ml pro Tag) ausreichend, bei hierunter ausbleibendem Natriumanstieg Erhöhung der renalen Molenlast durch die Gabe von Harnstoff-Mischung falls vorhanden, sonst Kochsalztabletten
- Schwere Hypothyreose: Substitution L-Thyroxin
4. Hypovoläme Hyponatriämie
- Exsikkose: Parenterale Gabe von balancierten, kristalloiden Vollelektrolytlösungen (z. B. Jonosteril) unter Monitoring der Urinausscheidung und des Serum-Natriums (Gefahr der Überkorrektur bei zu schnellem Ausgleich des Flüssigkeitsdefizits!)
- Diuretika-Exzess: Pausierung/Reduktion der Diuretikatherapie, ggf. parenterale Flüssigkeitssubstitution
Und wenn es doch einmal zu schnell ging?
Wenn das Natrium im Serum zu schnell ansteigt (Ziel <8-10 mmol/24 Stunden) muss man den Natriumanstieg bremsen oder ggf. das Natrium wieder senken - der Netto-Anstieg zählt! Die Maßnahmen, die hierfür ergriffen werden müssen, können wir uns anhand der eben mühselig erarbeiteten Pathophysiologie herleiten: Es kann nur zu einem Anstieg des Natriums kommen, wenn entweder zu viel Natrium zugeführt wird (dieses Problem lässt sich leicht beheben: Zufuhr der hypertonen NaCl-Lösung stoppen) und/oder der Patient beginnt freies Wasser (= viel wenig konzentrierten Urin) auszuscheiden. Deshalb sollte bei der Korrektur der Hyponatriämie auch immer die Urinausscheidung im Auge behalten werden. Als erster Schritt um den Natriumanstieg zu bremsen kann ein Therapieversuch mit 5%-Glukoselösung intravenös erfolgen (=freies Wasser nachdem die Glucose verstoffwechselt wurde). Kommt es hierunter zu einem weiteren Anstieg des Natriums oder weiterhin ausgeprägter Diurese, sollte die Gabe von Desmopressin erfolgen (2 µg i.v. oder 20 µg nasal alle 8-12 Stunden). Durch Desmopressin wird die Niere “aus dem Spiel genommen” und auf die Ersatzbank verbannt. Die Urinausscheidung kommt kurzzeitig zum Erliegen, da durch das Desmopressin über Aquaporine nahezu alles an freiem Wasser rückresorbiert wird. Es gibt sogar das Konzept, dass man den Ausgleich des Natriums direkt unter Desmopressingaben (im Englischen als “DDAVP clamp” bezeichnet und z.B. im IBCC toll beschrieben) und kontinuierlicher hypertoner NaCl-Gabe durchführt. Der Patient darf dann allerdings auch oral keine Flüssigkeit zu sich nehmen, sonst droht ein (weiterer/erneuter) Abfall des Natriums. Also noch einmal zum Verständnis: Wenn ein Patient keinen Urin ausscheidet und keine Flüssigkeit zu sich nimmt/erhält, wird sich das Natrium im Serum nicht verändern. Nimmt man also die Urinausscheidung aus der Gleichung, was mit der DDAVP clamp der Fall ist, kann man über die Auswahl der parenteralen Flüssigkeit (beim durstenden Patienten, also eher etwas für sediertes ITS-Patientengut!) ziemlich exakt den Natriumanstieg kontrollieren (auch hierfür gibt es wieder verschiedene Formeln in der Kalkulator-App eurer Wahl).
TL; DR: Das Fazit
- Diagnose-Algorithmus: zunächst Pseudohyponatriämie ausschließen (BGA, Serumosmolalität), dann Unterscheidung zwischen ADH-abhängiger und ADH-unabhängiger Hyponatriämie (Urinosmolalität)
- “Aggressive” Therapie nur bei hyponatriämischer Enzephalopathie, sonst vorsichtige Therapie abhängig von der Ursache - im Idealfall erst bei vollständiger Diagnostik. Die Gefahr liegt bei den asymptomatischen Hyponatriämien in der Therapie selbst (v.a. bei SIADH, ADH-unabhängiger und hypovolämer Form)
Über den Autor:
Felix Sokolowski ist Arzt und Notarzt mit Begeisterung für Innere Medizin, #FOAM und Notfallmedizin und beinahe kindlicher Freude an medizinischen Rätseln. Weil er sogar im Biergarten stundenlang mit leuchtenden Augen über Hyponatriämien reden kann, haben wir ihn genötigt, diesen Beitrag mit uns zu schreiben.
Wie immer gilt: Der Einzelfall entscheidet. Der Artikel erhebt keinen Anspruch auf Vollständigkeit oder Richtigkeit und die genannten Empfehlungen sind ohne Gewähr. Angegebene Dosierungen stellen keine Therapieempfehlung dar und dürfen nicht ungeprüft übernommen werden. Die Verantwortung liegt ausschließlich bei den Behandelnden. Der Text stellt die Position des Autors dar und nicht unbedingt die etablierte Meinung und/oder Meinung von dasFOAM.



Vielen Dank für den super Artikel!
Eine Frage/Anmerkung:
Ab wann wäre denn die Symptomatik schwer genug die 3%ige NaCl-Lsg. einzusetzen? Reicht bei einem Natrium, bspw. von ca. 115 mmol/l, bereits eine unspezifische AZ-Reduktion oder Angabe von Unwohlsein, Übelkeit, et cetera. Hier würde dann sicherlich das Gros aller älteren Patienten bereits ohne höhergradig reduziertes Serum-Natrium einer 3%ige NaCl-Lsg. bedürfen. Das absolute Serum-Natrium soll uns ja zwar nicht leiten, aber welche Symptomatik sollte es definitiv und welche nicht? Krampfanfall, Koma etc. steht sicher außer Frage. Aber der Graubereich ist m.E. der häufigste klinische Fall. Und der bereitet immer wieder Schwierigkeiten. Soll man, soll man nicht…
Die europäische Leitlinie (Link im Artikel) definiert folgende schwere Symptome mit Empfehlung zur Gabe von hypertonem NaCl: Erbrechen, relevante B/C-Probleme (“cardiorespiratory distress”), Somnolenz, Krampfanfälle und Koma.
Moderate Syptome sind gemäß Leitlinie Übelkeit ohne Erbrechen, Verwirrtheitszustände und Kopfschmerzen. Hier ist Evidenz zur Empfehlung einer Gabe von hypertonem NaCl aus Sicht der Leitlinienautoren NICHT ausreichend, sodass empfohlen wird zunächst die Diagnostik einzuleiten und eine spezifische Therapie zu beginnen, in diese Gruppe wird sicherlich die Mehrheit der Patienten fallen.
Ein hervorragender Artikel für ein Thema, was einem in der Klinik quasi täglich begegnet, und trotzdem häufig nicht verstanden ist. Kleine Korinthe von mir: Beer-drinking-potomania ist doppelt gemoppelt bzw. ein Drink zuviel: das (viel) Trinken steckt bereits in poto- drin (von lat. potare: saufen, viel trinken).
Danke, toller Artikel. Darf man sich eine ähnliche Zusammenfassung auch für die Hypernatriämie wünschen?