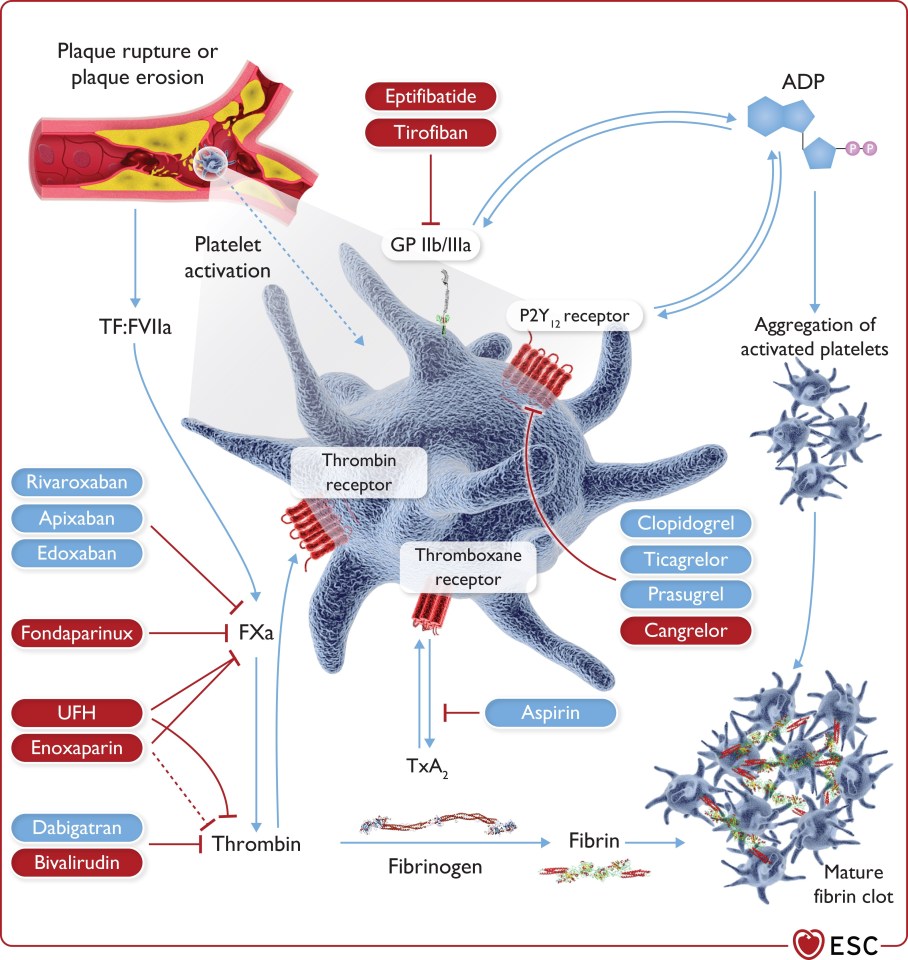
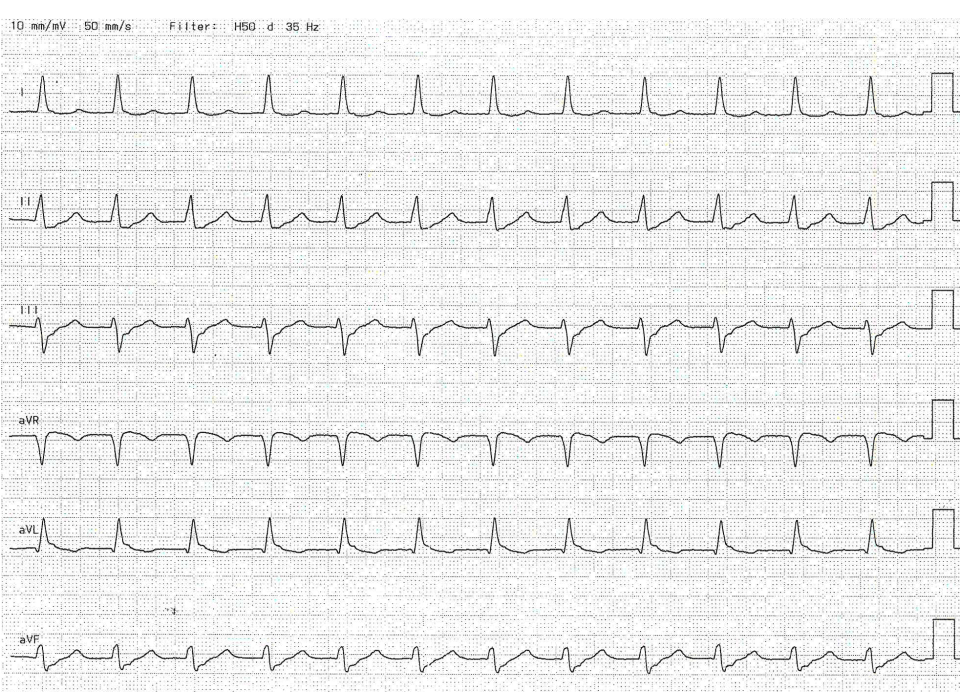
Die neue Leitlinie zum Akuten Coronar Syndrom ist auf dem Kongress der europäischen Gesellschaft für Kardiologie in Amsterdam veröffentlicht worden und hat es in sich. Hier ist sicher eine der größten Fortschritte und Paradigmawechsel der letzten Jahre zu finden. Das STEMI-Konzept ist eigentlich überholt und nicht mehr zeitgemäß, wir bei dasFOAM sind schon von der [...]
OMI light - die neue “ACS” Leitlinie