CRASH 3 – Tranexamsäure für alle (bei denen ein Nutzen bewiesen wurde)
Am 14.10.2019 wurde die CRASH-3 Studie veröffentlicht. Und das sogar “open access”.
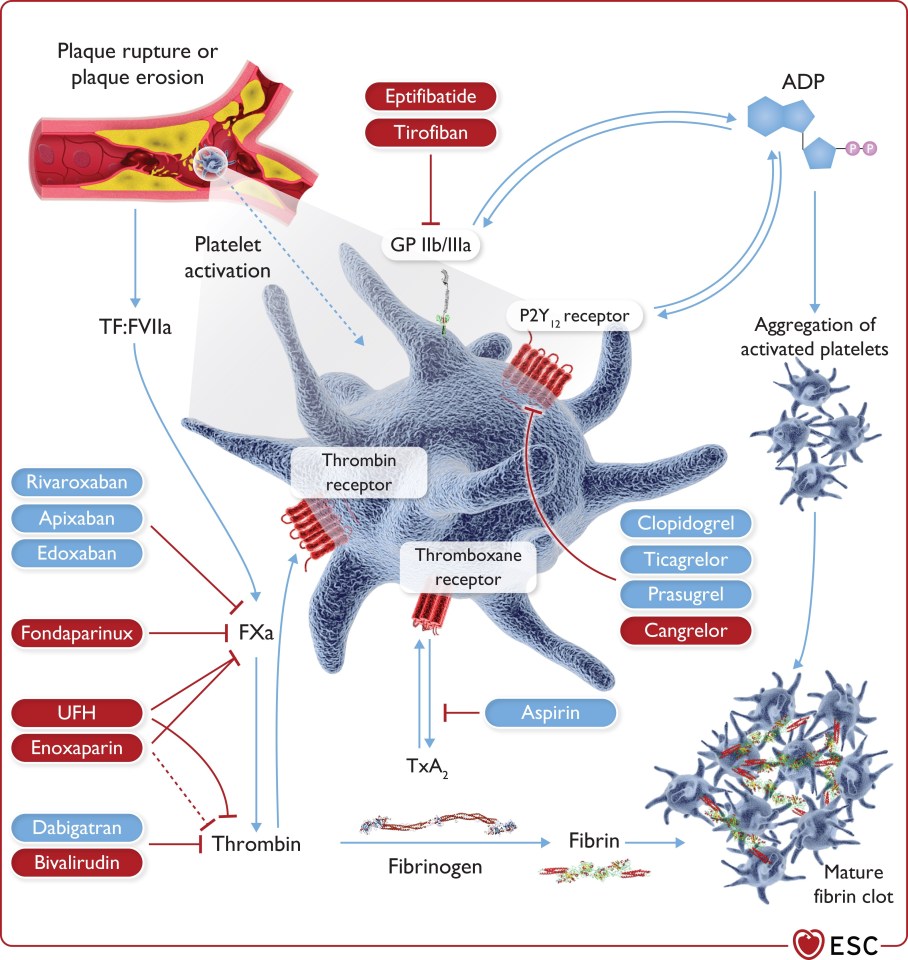
Tranexamsäure (TXA) gibt es schon seit längerem, 1962 um genau zu sein, und seitdem ist es in Gebrauch für verschiedenste - natürlich blutende - Angelegenheiten: Nasenbluten, Zahn-OPs, starke Menstruation, postpartale Blutung und die massive Blutung nach Trauma. Für die breite Notfallmedizin, insbesondere für die Präklinik, wurde es erst vor Kurzem richtig interessant. Nach der Veröffentlichung von CRASH-2, einer randomisierten, doppelt-verblindeten Studie mit über 20.000 Patienten, festigte sich international die Annahme, dass TXA bei massiver Blutung frühzeitig verabreicht werden sollte. TXA fand damit Aufnahme in verschiedenste Leitlinien.